Saccharose und Maltose
Heute redet jeder über Kohlenhydrate, aber die wissen nicht alle, was sie sind. Maltose und Saccharose sind verschiedene Kohlenhydrate. Maltose, aus zwei Glucosemolekülen bestehend, ist reduzierend, während Saccharose, bestehend aus einem Glucose- und einem Fructosemolekül, nicht reduzierend ist. Wie die zwei Zucker gewonnen werden und wie sie verwendet sind, wirst du im folgenden Video lernen.
- Saccharose
- Saccharose – Strukturformel
- Saccharose – Eigenschaften
- Saccharose – Vorkommen und Verwendung
- Saccharose – Synthese und Herstellung
- Saccharose – Nachweis
- Maltose
- Maltose – Strukturformel
- Maltose – Eigenschaften
- Maltose – Vorkommen und Verwendung
- Maltose – Synthese und Herstellung
- Maltose – Nachweis
- Maltose und Saccharose im Vergleich
- Ausblick – das lernst du nach Saccharose und Maltose
- Zusammenfassung zu Saccharose und Maltose
- Häufig gestellte Fragen zum Thema Saccharose und Maltose

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Saccharose und Maltose
Saccharose und Maltose
Mit unserer Nahrung nehmen wir täglich Zucker zu uns – oft auch unbewusst. Zucker gehört zu den Kohlenhydraten und ist ein wichtiger Energielieferant für unseren Körper. Doch Zucker ist nicht gleich Zucker. Im Folgenden beschäftigen wir uns mit Saccharose und Maltose. Was sie unterscheidet, welche Gemeinsamkeiten sie haben und welche Eigenschaften sie besitzen, schauen wir uns nun an.
Erinnerst du dich noch?
Es gibt viele verschiedene Kohlenhydrate. Das sind Polysaccharide, also Vielfachzucker, deren Moleküle sich aus Monosacchariden (Einfachzuckern) zusammensetzen. Die Einfachzucker Glucose und Fructose sind die wichtigsten Grundbausteine der Kohlenhydrate.
Saccharose
Sehen wir uns also zuerst die Saccharose an.
Die Saccharose ist ein Disaccharid, also ein Zweifachzucker. Ein Molekül Saccharose setzt sich aus den beiden Einfachzuckern
Aus dem Alltag kennst du Saccharose als Haushaltszucker. Was wir für gewöhnlich als Zucker bezeichnen, ist also nur ein spezielles Disaccharid.
Saccharose – Strukturformel
Die Summenformel von Saccharose lautet $\ce{C12H22O11}$. Die Summenformeln von Glucose und Fructose lauten jeweils $\ce{C6H12O6}$. Wenn sich die beiden Einfachzucker zu einem Saccharosemolekül verbinden, verdoppelt sich also die Anzahl der Atome nicht einfach. Wie du siehst, fehlen in der Summenformel der Saccharose zwei
$\ce{\underbrace{C6H12O6}_{\text{Glucose}} + \underbrace{C6H12O6}_{\text{Fructose}} -> \underbrace{C12H22O11}_{\text{Saccharose}} + \underbrace{H2O}_{\text{Wasser}}}$
So entsteht eine glykosidische Bindung: Der Sechsring der
Kurz gesagt: Die Strukturformel der Saccharose ergibt sich aus den Strukturformeln der
Eine Ringöffnung ist möglich, allerdings entsteht dabei, anders als bei vielen anderen Zuckern, keine freie
Saccharose – Eigenschaften
Wir wollen nun einige wichtige Eigenschaften der Saccharose betrachten:
- Saccharose ist unter Normalbedingungen ein weißer, kristalliner Feststoff, der auch Haushaltszucker, Kristallzucker oder Sucrose genannt wird.
- Die Dichte $\rho$ von Saccharose beträgt $\pu{1,57 g//cm3}$.
- Die molare Masse $M$ des Moleküls beträgt $\pu{342,30 g//mol}$.
- Saccharose schmilzt bei ca. $\pu{185 °C}$, wobei sie sich zu einer braunen Masse zersetzt, die dir vielleicht als Karamell bekannt ist.
- Saccharose ist sehr gut wasserlöslich. So können (bei Raumtemperatur) bis zu $\pu{2 kg}$ Saccharose in $\pu{1 \ell}$ Wasser gelöst werden.
- Saccharose schmeckt süß. Ihr wird auf der Skala der relativen Süßkraft der Wert $1$ bzw. $100\,\%$ zugeordnet. Sie liegt damit zwischen der Glucose und der Fructose.
- Saccharose ist brennbar und verbrennt unter Entstehung von Zuckerkohle.
- Saccharose wirkt nicht reduzierend, da selbst bei Ringöffnung keine freie
Aldehydgruppe $\left( \ce{-CHO} \right)$ vorliegt, die zu einerCarboxylgruppe $\left( \ce{-COOH} \right)$ oxidiert werden könnte. Daher ist Saccharose auch nicht durch die Fehling-Probe nachweisbar. - Da Saccharose nicht oder nur schwer oxidiert, ist Haushaltszucker im Vergleich zu anderen Zuckern deutlich haltbarer und kann gut als Lebensmittelzusatzstoff verwendet werden (als Süßungsmittel oder auch als Konservierungsmittel).
- Das Saccharosemolekül ist chiral und damit optisch aktiv. Trifft linear polarisiertes Licht auf die Moleküle, wird die Polarisationsebene gedreht. Der spezifische Drehwinkel $\alpha$ beträgt ${+}66{,}5\,^\circ\frac{\text{ml}}{\text{dm}\,\text{g}}$. Durch diesen physikalischen Vorgang können die Moleküle verschiedener Zucker voneinander unterschieden werden, denn es besteht ein direkter Zusammenhang zwischen Chiralität und optischer Aktivität.
Kennst du das?
Vielleicht hast du schon einmal beobachtet, wie Karamell hergestellt wird. Dabei wird Zucker erhitzt und karamelisiert, was ihn braun und aromatisch macht. Dieses Karamellisieren ist ein chemischer Prozess, bei dem Saccharose in Glukose und Fruktose gespalten wird, die dann weiter reagieren. Beim nächsten Mal, wenn du Karamell isst, weißt du, dass du gerade ein kleines chemisches Wunder in deinem Mund hast!
Saccharose – Vorkommen und Verwendung
Für Saccharose gibt es viele Trivialnamen: Haushaltszucker, Kristallzucker, Rübenzucker oder Rohrzucker sind einige Bezeichnungen. Gewonnen wird Saccharose aus dem Zuckerrohr, der Zuckerrübe oder der Zuckerpalme. Um
In der Biologie der Pflanzen ist Saccharose besonders bedeutsam. Als sogenannter Transportzucker wird Saccharose in den grünen Blättern aus Glucose und Fructose gebildet und in alle Pflanzenbestandteile zur Energiegewinnung transportiert.
Weitere Vorkommen der Saccharose:
- Saccharose ist von Natur aus in vielen Obstsorten bzw. Früchten enthalten. Die Ananas ist dabei Spitzenreiter mit einem Anteil von fast acht Prozent.
- Industriell verarbeitete Lebensmittel enthalten oft versteckten Zucker, ein Teil davon ist Saccharose. Sie dient dabei nicht so sehr als Nährstoff, sondern hauptsächlich der Verbesserung des Geschmacks (als Süßungsmittel). So hat beispielsweise Tomatenketchup einen Zuckeranteil von rund $20\,\%$, d. h. von $100\,\text{g}$ Ketchup sind ca. $20\,\text{g}$ reine Saccharose – das sind etwa $50$ Zuckerwürfel in einer großen Flasche $\left( 800\,\text{ml} \right)$. Bei anderen Lebensmitteln wie Marmelade, Keksen, Schokolade und anderen Süßigkeiten ist der Zuckeranteil oft noch deutlich höher.
- Hochprozentige Spirituosen wie Obstbrand oder Rum werden aus saccharosehaltigen Obstsorten bzw. Zuckerrohrmelasse hergestellt.
- Auch in vielen süßen Softdrinks ist Saccharose enthalten (in Limonaden und Cola beispielsweise ca. $10\,\%$).
Schlaue Idee
Verwende Saccharose beim Einmachen von Marmelade. Sie wirkt als Konservierungsmittel, indem sie den Wassergehalt reduziert und das Wachstum von Mikroorganismen hemmt.
Saccharose ist das wichtigste Süßungsmittel, das wir zum Kochen und Backen benutzen, ist aber vor allem auch in vielen industriell hergestellten Lebensmitteln enthalten. Wie du sicher schon weißt, ist ein übermäßiger Zuckerkonsum nicht gerade gesund. Saccharose ist zwar ein Energielieferant für unseren Körper und hat damit durchaus einen gewissen Nährwert, wird aber meist in viel zu großen Mengen und viel zu oft konsumiert. Das bringt einerseits das Risiko von Karies in der Mundhöhle mit sich, andererseits wird überschüssiger Zucker zu Fett umgewandelt, was zu Übergewicht und damit einhergehenden gesundheitlichen Problemen führen kann (beispielsweise zu einem erhöhten Herzinfarktrisiko). Auch verschiedene Stoffwechselerkrankungen werden mit übermäßigem Zuckerkonsum in Verbindung gebracht, v. a. die Zuckerkrankheit (Diabetes mellitus), bei der der Zuckerstoffwechsel nachhaltig gestört ist.
Es gibt Menschen, die eine Saccharoseintoleranz haben, also eine Unverträglichkeit von Haushaltszucker. Solche Menschen vertragen die Aufnahme von Saccharose nur schlecht oder gar nicht. Es kann zu Bauchschmerzen, Krämpfen, Durchfall und Erbrechen kommen.
Eine Ernährung ganz ohne Saccharose ist prinzipiell möglich, denn als Ersatz können wir auch Glucose (Traubenzucker), Fructose (Fruchtzucker) oder Lactose (Milchzucker) zu uns nehmen. Außerdem kann unser Körper die zur Energiegewinnung nötige Glucose auch aus anderen Kohlenhydraten bzw. Vielfachzuckern wie der Stärke herstellen. So wird bei einer durchschnittlichen Ernährung der Großteil unseres Energiebedarfs bereits mit Kohlenhydraten wie Stärke aus Kartoffeln, Nudeln, Reis oder Brot abgedeckt.
Allerdings wird Saccharose heutzutage so vielen industriell hergestellten Lebensmitteln zugesetzt (beispielsweise auch in herzhaften Aufstrichen, Soßen, Fertiggerichten wie Suppen sowie Fleisch- und Wurstwaren), dass es gar nicht so leicht ist, komplett auf den Haushaltszucker zu verzichten.
Achtung: Zu häufiger und übermäßiger Konsum von Saccharose und Zucker im Allgemeinen kann negative Folgen auf deine Gesundheit haben: Karies, Diabetes, Übergewicht oder Verdauungsstörungen sind nur einige. Die Empfehlung der Weltgesundheitsorganisation liegt für Erwachsene derzeit bei maximal 50 Gramm Zucker pro Tag. Ein Glas Limonade enthält bereits etwa 25 Gramm.
Saccharose – Synthese und Herstellung
Saccharose kann in industriellem Maßstab aus Zuckerrohr, Zuckerrüben oder der Zuckerpalme gewonnen werden. Dies sind Pflanzen, die einen besonders hohen Anteil an Saccharose aufweisen. Prinzipiell kann aber jede Pflanze, die Fotosynthese betreibt, Kristallzucker herstellen. Denn bei der Fotosynthese entsteht Glucose (Traubenzucker), die in den grünen Blättern der Pflanze zusammen mit Fructose (Fruchtzucker) zu Saccharose (Kristallzucker, in der Pflanze auch Transportzucker genannt) synthetisiert werden kann. Die entsprechende chemische Reaktion haben wir weiter oben schon betrachtet:
$\ce{\underbrace{C6H12O6}_{\text{Glucose}} + \underbrace{C6H12O6}_{\text{Fructose}} -> \underbrace{C12H22O11}_{\text{Saccharose}} + \underbrace{H2O}_{\text{Wasser}}}$
Durch diese Synthesereaktion kann auch mit technischen Mitteln im Labor aus Glucose und Fructose künstlich Saccharose hergestellt werden.
Im menschlichen Körper geschieht genau der umgekehrte Vorgang: Durch unsere Verdauung werden Polysaccharide (Vielfachzucker) wie Stärke mithilfe von Enzymen wie der Amylase u. a. zu Disacchariden wie der Saccharose aufgespalten – und diese letztendlich zu den Monosacchariden Glucose und Fructose, die uns als Energielieferanten dienen.
Ein Gemisch, in dem Glucose und Fructose getrennt, also als Einfachzucker nebeneinander vorliegen, wird als Invertzucker bezeichnet.
Saccharose – Nachweis
Wie bereits erwähnt, verfügt das Saccharosemolekül auch bei Ringöffnung über keine freie
Es ist allerdings möglich, Saccharose zuerst chemisch in die Bestandteile Glucose und Fructose aufzuspalten, um diese dann einzeln mit den erwähnten Mitteln nachzuweisen.
Eine Möglichkeit, Saccharose direkt nachzuweisen, stellt die Hochleistungsflüssigchromatografie (HPLC) dar, ein relativ aufwändiges chromatografisches Verfahren.
Maltose
Kommen wir nun zur Maltose. Vielleicht hast du schon einmal den Begriff Malzzucker gehört. Das ist nichts anderes als Maltose. Sie ist beispielsweise in Gerstenmalz zu finden.
Die Maltose gehört, wie auch die Saccharose, zu den Kohlenhydraten. Genau wie die Saccharose ist sie ein Disaccharid (Zweifachzucker). Das Maltosemolekül setzt sich allerdings aus zwei gleichen Molekülen
Maltose – Strukturformel
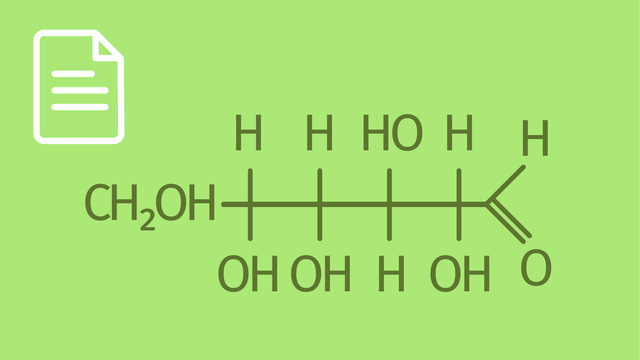
Um die Strukturformel des Maltosemoleküls zu verstehen, sehen wir uns zuerst wieder die Summenformel an. Die lautet genau wie die der Saccharose: $\ce{C12H22O11}$. Während Saccharose aus Glucose und Fructose zusammengesetzt ist, besteht das Maltosemolekül aus zwei Glucosemolekülen. Da Glucose und Fructose jedoch die gleiche Summenformel haben $\left( \ce{C6H12O6} \right)$, ist hier auch noch kein Unterschied zwischen Saccharose und Maltose zu erkennen $\left( \ce{C12H22O11} \right)$. Und auch bei der Maltose findet die Verknüpfung der beiden Einfachzucker wieder über eine glykosidische Bindung statt (unter Abspaltung eines Wassermoleküls):
$\ce{\underbrace{C6H12O6}_{\text{Glucose}} + \underbrace{C6H12O6}_{\text{Glucose}} -> \underbrace{C12H22O11}_{\text{Maltose}} + \underbrace{H2O}_{\text{Wasser}}}$
Erst die Strukturformel, die wir uns wieder in der Haworth-Projektion ansehen, macht den Unterschied deutlich. Die Bildung einer Sauerstoffbrücke läuft ganz ähnlich ab, wie bei der Saccharose beschrieben, allerdings hier zwischen dem anomeren Kohlenstoffatom $\ce{C1}$ des ersten
Kurz gesagt: Die Strukturformel der Maltose ergibt sich aus den Strukturformeln zweier
Es gibt auch eine Form der Maltose, bei der die Kohlenstoffatome $\ce{C1}$ (des ersten) und $\ce{C6}$ des zweiten Glucosemoleküls verknüpft werden. Diese Form wird Isomaltose genannt. Hier liegt eine
Im Gegensatz zur Saccharose ist Maltose kein Acetal, sondern ein Halbacetal. Das bedeutet, dass in diesem Fall bei einer Ringöffnung sehr wohl eine freie
Maltose – Eigenschaften
Wir wollen nun einige wichtige Eigenschaften der Maltose betrachten:
- Maltose ist unter Normalbedingungen ein weißer, kristalliner Feststoff, der auch Malzzucker genannt wird.
- Die Dichte $\rho$ von Maltose beträgt $\pu{1,54 g//cm3}$.
- Die molare Masse $M$ des Moleküls beträgt $\pu{342,30 g//mol}$.
- Maltose schmilzt bei Temperaturen von $160\text{–}\pu{165 °C}$ (wasserfrei).
- Maltose ist gut wasserlöslich. So kann (bei Raumtemperatur) bis zu $\pu{1 kg}$ Maltose in $\pu{1 \ell}$ Wasser gelöst werden. Die Wasserlöslichkeit von Maltose ist damit allerdings geringer als die von Saccharose.
- Maltose schmeckt süßlich. Die relative Süßkraft dieses Zweifachzuckers liegt bei $30{–}50\,\%$, bezogen auf Saccharose $\left( 100\,\% \right)$, und ist damit auch geringer als die der Glucose.
- Maltose ist brennbar, wie alle Kohlenhydrate.
- Maltose wirkt reduzierend (bei Ringöffnung) aufgrund der freien
Aldehydgruppe $\left( \ce{-CHO} \right)$. Maltose ist damit (wie Glucose) durch die Fehling-Probe nachweisbar. - Das Maltosemolekül ist (wie die Saccharose) chiral und damit optisch aktiv. Diese Eigenschaft haben alle Disaccharide, wobei sich die spezifischen Drehwinkel unterscheiden. Bei Maltose beträgt der spezifische Drehwinkel $\alpha$ ca. ${+}130\,^\circ\frac{\text{ml}}{\text{dm}\,\text{g}}$.
Wusstest du schon?
Maltose spielt eine wichtige Rolle bei der Herstellung von Bonbons und Bier. Tatsächlich nutzten schon die alten Ägypter Malzzucker bei der Herstellung von Brot und alkoholischen Getränken – eine Tradition, die über 4.000 Jahre alt ist!
Maltose – Vorkommen und Verwendung
Maltose wird umgangssprachlich oft als Malzzucker bezeichnet und findet sich in hohen Konzentrationen in Pflanzenkeimen, beispielsweise Gerstenkeimen (Gerstenmalz). Maltose ist ein Grundbaustein der Stärke. Das heißt auch, dass Stärke zu Maltose zersetzt werden kann. Dies geschieht teilweise schon im Mund beim Kauen durch das Enzym Amylase im Speichel (die Speichelamylase). Deshalb schmecken Getreideprodukte wie Brot auch leicht süßlich, wenn man sie nur lange genug kaut. Die Maltose hat einen karamellartigen Geschmack. Auch in Reinform findet sie Verwendung in zahlreichen Lebensmitteln:
- in Backwaren
- in Getränken
- in Süßwaren
- in Spirituosen
- in Kindernahrung
- in Malzkaffee
Eine besonders große Rolle spielt Maltose beim Bierbrauen. Sie entsteht beim Mälzen, also dem kontrollierten Keimen von Getreide. Der Malzzucker kann von der Bierhefe zu Alkohol (genauer gesagt Ethanol) umgewandelt werden. Dies ist ein wesentlicher Vorgang der alkoholischen Gärung beim Bierbrauen.
Außerdem wird Maltose in der Biotechnologie in Nährmedien für Zellkulturen eingesetzt, denn wie alle Zucker dient auch die Maltose als Energielieferant für Lebewesen, da sie zu Glucose aufgespalten werden kann.
Maltose – Synthese und Herstellung
Maltose kann technisch aus Glucose synthetisiert werden, das haben wir weiter oben schon gesehen:
$\ce{\underbrace{C6H12O6}_{\text{Glucose}} + \underbrace{C6H12O6}_{\text{Glucose}} -> \underbrace{C12H22O11}_{\text{Maltose}} + \underbrace{H2O}_{\text{Wasser}}}$
Dieser Prozess findet auch in Pflanzen statt, die durch Fotosynthese selbst Glucose produzieren und daraus Zweifachzucker wie Maltose herstellen können.
Umgekehrt kann Maltose auch gewonnen werden, wenn Vielfachzucker wie Stärke aufgespalten werden. Dies geschieht beispielsweise bei unserer Verdauung mithilfe des Enzyms Amylase (wobei hier die Maltose in der Regel am Ende zu Glucose zersetzt wird). Auch dieser Prozess lässt sich technisch nachbilden. Im industriellen Maßstab wird Maltose hauptsächlich aus Stärke (von Pflanzen) gewonnen.
Maltose – Nachweis
Wie bereits erwähnt, ist Maltose ein Halbacetal und kann deshalb (genau wie Glucose) mit gängigen Aldehydnachweisen wie der Fehling-Probe und der Tollens-Probe (Silberspiegelprobe) nachgewiesen werden. Dies funktioniert deshalb, weil die Maltose in einer Probe in der Regel sowohl in Ringform als auch in geöffneter Form vorliegt. Letztere führt aufgrund der freien
Es gibt auch einen Nachweis, der selbst bei geschlossener Ringform funktioniert: Wenn eine Probe, die Maltose enthält, in eine Ammoniaklösung gegeben wird, färbt sich diese durch die Bildung eines Farbstoffes rot. Dieser Nachweis schließt allerdings nicht aus, dass auch andere Disaccharide in der Probe vorhanden sein könnten.
Maltose und Saccharose im Vergleich
Maltose und Saccharose haben vieles gemeinsam:
- Bei beiden organischen Verbindungen handelt es sich um Kohlenhydrate, genauer gesagt um Disaccharide (Zweifachzucker).
- Beide Stoffe sind kristalline, wasserlösliche Feststoffe.
- Sie dienen beide als biochemischer Energielieferant und schmecken süß.
- In den Molekülen der beiden Stoffe gibt es je eine glykosidische Bindung.
- Die Summenformeln beider Verbindungen sind gleich: $\ce{C12H22O11}$.
Kontrovers diskutiert:
Aktuellen Forschungsergebnissen zufolge ist Saccharose schädlicher für die Gesundheit als Maltose. Einige Wissenschaftlerinnen und Wissenschaftler argumentieren, dass der höhere Fructosegehalt in Saccharose das Risiko für Fettleibigkeit und Lebererkrankungen erhöht. Andere Forscherinnen und Forscher meinen jedoch, dass es auf die Gesamtzuckermenge und nicht auf die Art des Zuckers ankomme. Was denkst du?
Es gibt allerdings auch einige wichtige Unterschiede, die wir in der folgenden Tabelle noch einmal beispielhaft zusammenfassen wollen:
| Maltose | Saccharose | |
|---|---|---|
| Trivialname | Malzzucker | Haushaltszucker |
| Grundbausteine | 2x Glucose | Glucose + Fructose |
| Vorkommen (Beispiele) | Getreidekeime | Obst, Zuckerrüben |
| Süßkraft | $0{,}3\text{–}0{,}5$ | $1$ |
| optische Aktivität | ja, Drehwinkel ${+}130\,^\circ$ | ja, Drehwinkel ${+}66{,}5\,^\circ$ |
| reduzierende Wirkung | ja (Halbacetal) | nein (Acetal) |
Die Unterschiede zwischen den beiden Zweifachzuckern sind im Wesentlichen in den unterschiedlichen Molekülstrukturen begründet.
Ausblick – das lernst du nach Saccharose und Maltose
Vertiefe dein Wissen rund um Kohlenhydrate und beschäftige dich mit Glucose und Fructose. Kohlenhydrate in der Chemie und Disaccharide geben dir weitere Einblicke.
Zusammenfassung zu Saccharose und Maltose
- Saccharose und Maltose sind Disaccharide, also Zweifachzucker. Sie zählen damit zu Kohlenhydraten.
- Ein Saccharosemolekül setzt sich aus den Einfachzuckern Glucose und Fructose zusammen. Die Verknüpfung findet über eine
$\alpha{,}\beta\text{-}1{,}2$-glykosidische Bindung statt. - Ein Maltosemolekül setzt sich aus zwei Glucosemolekülen zusammen. Die Verknüpfung findet über eine
$\alpha\text{-}1{,}4$-glykosidische Bindung statt. - Saccharose ist ein Acetal, Maltose ist ein Halbacetal und verfügt als solches nach der Ringöffnung über eine freie
Aldehydgruppe $\left( \ce{-CHO} \right)$. - Saccharose hat demnach keine reduzierende Wirkung, Maltose schon.
- Beide Zweifachzucker können in Pflanzen aus Glucose (und Fructose) synthetisiert werden, aber auch durch die Aufspaltung von Vielfachzuckern (z. B. Stärke) hergestellt werden.
- Sowohl Saccharose als auch Maltose dienen als Energielieferant für Lebewesen, da sie zu Glucose (und Fructose) zersetzt werden können.
- Beide Stoffe werden als Süßungsmittel in vielen Lebensmitteln eingesetzt, wobei Saccharose als Haushaltszucker in dieser Hinsicht die wichtigere Rolle spielt.
Häufig gestellte Fragen zum Thema Saccharose und Maltose
Transkript Saccharose und Maltose
Guten Tag und herzlich willkommen!
In diesem Video geht es um Saccharose und Maltose. Der Film gehört zur Reihe "Kohlenhydrate". In Vorbereitung solltest du entsprechende Videos über Kohlehydrate, Monosaccharide, Glucose und Fructose bereits gesehen haben. Ziel des Videos ist es, wichtige Eigenschaften von Saccharose und Maltose zu besprechen.
Den Film habe ich folgendermaßen unterteilt: Saccharose 1. Geschichte 2. Rohstoffe 3. Eigenschaften 4. Transportzucker 5. Nahrungs- und Genussmittel 6. Spirituosen und 7. Folgen des Missbrauchs.
Zur Maltose gibt es die Themen: 8. Eigenschaften und 9. Bierbrauen.
Es folgt das Abschlussthema 10 - Zusammenfassung.
Saccharose 1. Geschichte
Um die Geschichte zu verstehen, müssen wir wissen, dass es sich bei Saccharose um gewöhnlichen Haushaltszucker handelt. Für die Zeit vor etwa 10000 Jahren datieren die ältesten Zuckerrohrfunde. Um 1100 brachten die Kreuzritter den Zucker nach Europa. 1747 fand Andreas Sigismund Marggraf in der Zuckerrübe den Zucker. Um 1800 entwickelte Franz Carl Archard die erste industrielle Zuckerproduktion. 1840 entwickelte Jacob Christoph Rad, hier ein Foto mit seiner Ehefrau, ein Verfahren zur Herstellung von Würfelzucker. 1900 wurden weltweit bereits 11 Mio. t Zucker produziert.
- Rohstoffe
Haushaltszucker, einfach Zucker, wird auch als Kristallzucker, Rübenzucker oder Rohrzucker bezeichnet. Gewonnen wird er aus dem Zuckerrohr, der Zuckerrübe oder der Zuckerpalme.
- Eigenschaften
Bei Saccharose handelt es sich um ein Kohlenhydrat. Es ist ein Disaccharid. Saccharose besteht aus den beiden Bausteinen: α-D-Glucose und β-D-Fructose. Zwischen beiden Molekülen gibt es eine α,β-1→2-glykosidische Bindung. Die Dichte der Saccharose ist vergleichbar mit den Dichten von Glucose und Fructose, 1,57 g/cm³. Saccharose schmilzt bei ca. 185°C unter Zersetzung. Saccharose ist wasserlöslich, 2 kg lösen sich in einem Liter Wasser. Die Süßkraft der Saccharose liegt zwischen Fructose und Glucose. Saccharose verbrennt unter Entstehung von Zuckerkohle. Und nun eine ganze wichtige Eigenschaft: Saccharose ist nicht reduzierend.
Vielleicht habt Ihr einmal den Begriff Invertzucker gehört. Wenn Saccharose hydrolysiert, bilden sich die Bausteine Glucose und Fructose. Alle 3 Zuckermoleküle sind optisch aktiv. Der spezifische Drehwinkel von Saccharose beträgt +66°. Das Gemisch der beiden Einfachzucker liefert einen Drehwinkel von -20°. Die Umkehrung des Drehwinkels von rechtsdrehend zu linksdrehend wird als Inversion bezeichnet.
- Transportzucker
Die Eigenschaft "nicht reduzierend" bedeutet für Saccharose gleichfalls, dass Saccharose nicht einfach oxidierbar ist. Das unterscheidet die Saccharose vorteilhaft von den Hexosen. In der Pflanzenzelle findet ein Saccharosetransport statt. Ein passiver Transport findet zu den Zellwänden und Zellzwischenräumen statt. Man nennt diese auch Apoplaste. Darauf folgt ein aktiver Transport zum Phloem (Siebteil).
- Saccharose als Nahrungs- und Genussmittel
Saccharose ist in vielen Obstsorten enthalten. Äpfel enthalten 2,4 % Saccharose, Birnen nur 1,1 %, Erdbeeren 1,3 %, Himbeeren 1,0 %. Die Ananas ist am süßesten mit 7,9 %, gefolgt von den Bananen mit 6,6 %. Aprikosen enthalten immerhin noch 4,4 % Saccharose. Viele unserer Lebensmittel enthalten sogenannten versteckten Zucker. Ein Teil davon ist Saccharose. Im Speiseeis sind 20 % Zucker, im Apfelsaft 12 %. Cola enthält 11 %, Honig gewaltige 80 %, Marmelade 70 %, Vollmilchschokolade 56 %, Milchkaramell 84 %, in Bonbons sind über 90 % Zucker. Die heiß geliebten Gummibärchen enthalten 50 % und Ketchup ist mit 34 % dabei.
- Spirituosen
Es gibt einen hochprozentigen Alkohol, der unter verschiedenen Namen bekannt ist. Man nennt ihn Obstler, Obstwasser oder Obstbrand. Obstler stellt man her aus Äpfeln, Birnen, Kirschen, Zwetschgen, Mirabellen oder Aprikosen. Zwei weitere hochprozentige Getränke werden nicht in Europa hergestellt: Cachaca und Rum. Cachaca stellt man direkt aus Zuckerrohr her, Rum aus Zuckerrohrmelasse.
- Folgen des Missbrauchs
Zu häufiger und zu starker Konsum von Saccharose kann zu üblen Folgen führen. Einmal kann das Karies sein. Auch Diabetes kann verstärkt ausgelöst werden. Weitere traurige Folgeerscheinungen sind Fettleibigkeit und Herzinfarkt. Daher soll nicht mehr als 10 % des täglichen Nahrungsmittelkonsums aus Zucker bestehen.
Betrachten wir nun noch kurz die Maltose, sie wird als Malzzucker bezeichnet.
- Eigenschaften
Ein Maltosemolekül besteht aus Molekülen von α-D-Glucose. Diese Bausteine sind über eine α-1→4-glykosidische Verbindung verknüpft. Maltose ist ein Kohlenhydrat. Es ist ein Disaccharid. Sein Baustein ist die α-D-Glucose. Maltose ist ein Hydrolyseprodukt der Stärke. Einer der Bestandteile der Stärke ist die Amylose. Maltose schmilzt bei 160-165°C. Bei Raumtemperatur lösen sich 1 kg in 1 l Wasser. Im Gegensatz zu Saccharose ist Maltose ein reduzierender Zucker.
- Bierbrauen
Maltose spielt eine große Rolle beim Bierbrauen. Man erhält sie aus der Gerste, dem Malz. Dann benötigt man noch Hopfen und Wasser. Aus den Brauzutaten ergibt sich durch das Bierbrauen das Bier.
- Zusammenfassung
Im Video wurden wichtige Eigenschaften von Saccharose und Maltose betrachtet. Bei beiden handelt es sich um Kohlenhydrate, Disaccharide. Die Bausteine der Saccharose sind α-D-Glucose und β-D-Fructose. Maltose besteht aus 2 Molekülen α-D-Glucose. Saccharose ist nicht reduzierend. Maltose ist ein reduzierender Zucker. Saccharose ist biologisch bedeutsam. Maltose ist ein Spaltprodukt der Stärke, wird auch als Malzzucker bezeichnet. Saccharose ist nach wie vor ein populäres Süßungsmittel. Es ist jedoch Vorsicht bei Überkonsum geboten.
Ich danke für Eure Aufmerksamkeit. Alles Gute, auf Wiedersehen!
Saccharose und Maltose Übung
-
Fasse die Geschichte der Saccharose kurz zusammen.
TippsBeginne mit der Zeitangabe, die am weitesten zurückreicht.
LösungDie ältesten Funde können zurückdatiert werden auf bis zu $10\,000$ Jahre in die Vergangenheit. Es kann nachgewiesen werden, dass der Zucker bereits um $6\,000~\text{v. u. Z.}$ nach Persien und Indien gelangt ist. In Rom wurde Zucker vermutlich als Luxusgut gehandelt und wurde dann um $1\,100~\text{n. u. Z.}$ von den Kreuzrittern erneut nach Europa gebracht. Viele Jahrhunderte bleibt das Süßungsmittel ein Luxusgut. Den Zuckergehalt der Zuckerrübe entdeckte im Jahr $1747$ Andreas Sigismund Marggraf. Um $1800$ wurden dann die Grundlagen geschaffen, um Zucker industriell zu produzieren. Von Jacob Christoph Rad wurde $1840$ der Würfelzucker erfunden. Durch die industrielle Fertigung fiel nicht nur der Preis für Zucker, sondern er konnte bereits um $1900$ in Massen (ca. $11~\text{Mio t}$ pro Jahr) produziert werden.
-
Vergleiche Saccharose und Maltose.
TippsNutze die Bilder, um die Bausteine der Zucker herauszufinden.
LösungBeide Zucker sind Kohlenhydrate und Disaccharide. Sie sind beide in Wasser löslich und ihre Schmelzpunkte liegen bei über $150\,^\circ\text{C}$.
Saccharose setzt sich aus zwei verschiedenen Bausteinen zusammen: $\alpha$-D-Glucose und $\beta$-D-Fructose. Die Bausteine sind dabei über eine $\alpha$,$\beta$-glykosidische Bindung miteinander verknüpft. Weiterhin ist Saccharose nicht reduzierend und somit auch nicht leicht oxidierbar. In dieser Eigenschaft unterscheidet sich der Zucker von den anderen Hexosen. Saccharose ist ein Transportzucker. Ein passiver Transport findet dabei im Apoplasten statt und ein aktiver Transport zum Phloem (Siebteil). Aufgrund seiner Süßkraft wird der Zucker als Süßungsmittel eingesetzt. Dabei sollte darauf geachtet werden, wieviel man davon aufnimmt. Andernfalls kommt es zu schwerwiegenden Folgen (Diabetes, Fettleibigkeit oder Herzinfarkt).
Maltose setzt sich aus einem Baustein zusammen: $\alpha$-D-Glucose. Zwei dieser Bausteine sind dabei über eine $\alpha$-1,4-glykosidische Bindung miteinander verknüpft. Dieser Zucker gehört zu den reduzierenden Zuckern und ist ein Spaltprodukt des Polysaccharids Stärke. Er wird auch Malz(-zucker) genannt.
-
Formuliere die Gleichungen zu folgenden Reaktionen von Zuckern.
TippsDenke daran, auszugleichen.
LösungBei einer Verbrennung reagiert der entsprechende Stoff (hier Saccharose) mit Sauerstoff. Da eine vollständige Verbrennung stattfinden soll, gehört neben Wasser auch Kohlenstoffdioxid zu den Produkten. Um festzustellen, wieviel Mol der Stoffe eingesetzt werden bzw. entstehen, müssen wir die Anzahl Atome auf beiden Seiten des Reaktionspfeils vergleichen. Auf der Seite der Edukte sind <nobr>$12$ $\ce{C}$-Atome</nobr> zu zählen. Somit müssen $12~\text{mol}~ \ce{CO2}$ entstehen. In einem Mol Saccharose können $22\,\ce{H}$-Atome gezählt werden. Daraus ergeben sich $11~\text{mol}~\ce{H2O}$. Zuletzt kann mithilfe der Produkte die einzusetzende Menge Sauerstoff bestimmt werden. Auf der Seite der Produkte stehen <nobr>$11+(2 \cdot 12)\,\ce{O}$-Atome.</nobr> Insgesamt sind dies $35$. Saccharose enthält bereits $11$ Sauerstoffatome. Somit müssen weitere <nobr>$24\,\ce{O}$-Atome</nobr> eingesetzt werden. Da ein Molekül Sauerstoff aus zwei Atomen besteht, muss die gesuchte Anzahl $\left( 24 \right)$ noch durch zwei geteilt werden. Die richtige Lösung für das zweite Edukt ist also $12\,\ce{O2}$.
Als Hydrolyse bezeichnet man eine chemische Reaktion, bei welcher es zur Spaltung einer Verbindung mit Hilfe von Wasser kommt. Im Fall von Saccharose kommt zusätzlich Salzsäure zum Einsatz. Diese wirkt hier katalytisch. Ein Molekül Saccharose setzt sich zusammen aus $\alpha$-D-Glucose und $\beta$-D-Fructose. Somit ergibt sich als Summenformel für den Zucker $\ce{C12H22O11}$. Als Produkte entstehen die Bausteine des Zuckers. Diese haben beide dieselbe Summenformel: $\ce{C6H12O6}$. Vergleicht man am Ende die Anzahl der jeweiligen Atome auf beiden Seiten des Reaktionspfeils, dann stellt man fest, dass sie gleich sind.
-
Erkläre die Reaktion zwischen Zucker und Schwefelsäure.
TippsNutze die unvollständigen Wortgleichungen, um herauszufinden, welche Edukte eingesetzt werden und welche Produkte entstehen.
Es ist richtig ausgeglichen, wenn die Anzahl der jeweiligen Atome auf beiden Seiten des Reaktionspfeils gleich ist.
LösungBei der Reaktion von Saccharose $\left( \ce{C12H22O11} \right)$ mit Schwefelsäure $\left( \ce{H2SO4} \right)$ entsteht schweflige Säure $\left( \ce{H2SO3} \right)$. Da $2~\text{mol}$ Schwefelsäure eingesetzt werden, müssen auch $2~\text{mol}$ schweflige Säure entstehen $\left( \ce{2 H2SO3} \right)$. Vom ersten Edukt (Saccharose) werden in der Reaktionsgleichung nur die <nobr>$\ce{C}$-Atome</nobr> betrachtet. Beim Vergleich der Anzahl der Kohlenstoff- und Sauerstoffatome beider Seiten des Reaktionspfeils fällt auf, dass rechts ein <nobr>$\ce{C}$-Atom</nobr> und <nobr>$\ce{2 O}$-Atome</nobr> fehlen. Sie bilden das zweite Produkt: $\ce{CO2}$. Dieses ist unter anderem für die starke Volumenzunahme verantwortlich.
Bei der ersten Teilreaktion (der Oxidation) reagieren die Kohlenstoffatome $\left( \ce{C} \right)$ des Zuckers mit Wasser zu Hydronium-Ionen und Elektronen. Betrachtet man die Anzahl der <nobr>$\ce{H}$-Atome</nobr> auf Seiten der Edukte $\left( 2 \right)$ und Produkte $\left( 12 \right)$, dann wird klar, dass noch ausgeglichen werden muss. $\ce{6 H2O}$ ergeben sich daraus als richtige Lösung für das zweite Edukt der Oxidation. Rechts vom Reaktionspfeil muss als drittes Produkt $\ce{CO2}$ eingesetzt werden. Die Lösung ergibt sich daraus, dass ein <nobr>$\ce{C}$-Atom</nobr> links vom Reaktionspfeil steht und dass <nobr>$\ce{2 O}$-Atome</nobr> auf der Produktseite übrig bleiben.
Bei der Reduktion entstehen neben $3~\text{mol}$ Wasser auch $1~\text{mol}$ schweflige Säure. Der Grund hierfür ist bei den Edukten zu finden: Es wird nur $1~\text{mol}$ Schwefelsäure eingesetzt. Damit die Anzahl <nobr>$\ce{S}$-Atome</nobr> auf beiden Seiten gleich ist, muss $\ce{1 H2SO3}$ als Produkt entstehen. Aus der Wortgleichung ist zu entnehmen, dass das zweite Edukt Hydronium-Ionen $\left( \ce{H3O^+} \right)$ sind. Da die Summe der <nobr>$\ce{O}$-Atome</nobr> der Produkte $6$ ergibt und Schwefelsäure als erstes Produkt bereits <nobr>$\ce{4 O}$-Atome</nobr> besitzt, ist die richtige Lösung für das zweite Edukt $\ce{2 H3O^+}$.
Im Vergleich zur Gesamtreaktion fällt auf, dass dort $2~\text{mol}$ Schwefelsäure eingesetzt werden. Der Grund dafür ergibt sich, wenn man die Anzahl der Elektronen betrachtet. Bei der Oxidation entstehen $4$ Elektronen und bei der Reduktion werden nur $2$ Elektronen benötigt. Es muss folglich die letzte Reaktionsgleichung mal zwei genommen werden, um die Gesamtreaktion zu schreiben.
Die Volumenzunahme bei dem Experiment ist nicht nur auf das Gas $\ce{CO2}$ zurückzuführen, sondern ebenfalls auf Schwefeldioxid $\left( \ce{SO2} \right)$. Dieses entsteht neben Wasser durch den Zerfall der schwefligen Säure.
-
Bestimme die Lebensmittel, die einen hohen Anteil an verstecktem Kristallzucker beinhalten.
TippsZucker ist nicht auf den ersten Blick erkennbar.
Oft enthalten verarbeitete Lebensmittel viel Zucker.
LösungVersteckte Zucker sind meist nicht auf den ersten Blick zu erkennen. Sie sind oft in Lebensmitteln enthalten, die verarbeitet wurden. Daher gehört der Apfelsaft ($12\,\%$ versteckter Zucker) hier als richtige Lösung gekennzeichnet, nicht jedoch der Apfel. Letzterer ist ein natürliches Produkt und enthält nur $2{,}4\,\%$ Saccharose. Die Ananas hat mit $7{,}9\,\%$ Saccharose zwar einen sehr großen Anteil an Saccharose, ist aber wie der Apfel ein Produkt der Natur und wird somit nicht angekreuzt in dieser Aufgabe. Marmelade und Gummibärchen hingegen sind Produkte, die gefertigt wurden. Sie enthalten bis zu $70\,\%$ und $50\,\%$ an versteckten Zuckern. Besonders Süßigkeiten aller Art enthalten viel Zucker. Um nicht an Karies, Diabetes oder anderen Beschwerden zu erkranken, sollte die tägliche Menge an Zucker maximal $10\,\%$ der täglichen Nahrung ausmachen.
-
Arbeite den Nachweis von Disacchariden mit Fehling-Reagenz heraus.
TippsLies erst den ganzen Satz, bevor du ein Lücke füllst.
LösungMaltose besteht aus zwei Molekülen $\alpha$-D-Glucose, welche $\alpha$-1,4-glykosidisch miteinander verknüpft sind. Bei der Kopplung der Bausteine erfolgt eine Reaktion von zwei $\ce{OH}$-Gruppen. Es entstehen ein Zuckermolekül, bei dem die Bausteine über ein Sauerstoffatom verbunden sind und Wasser. Der rechte Glucose-Baustein der Maltose besitzt besitzt eine weitere glykosidische Gruppe, die allerdings ungebunden ist. Sie ist somit in der Lage, auch in der offenkettigen Form vorzuliegen. Dabei ist die Aldehyd-Gruppe frei, welche dem Zucker seine reduzierende Wirkung gibt. Da nun die Kupfer(II)-Ionen reduziert werden können, folgen dann die weiteren Teilreaktionen und es bildet sich der rot-braune Niederschlag.
Die Fehling-Probe fällt bei dem Zweifachzucker Saccharose negativ aus (es bildet sich kein Niederschlag). Der Grund dafür findet sich im Aufbau des Zuckermoleküls. Es besteht aus je einem Molekül $\alpha$-D-Glucose und $\beta$-D-Fructose, welche $\alpha$-1-$\beta$-2-glykosidisch verknüpft sind. Der rechte Baustein hat keine weitere ungebundene glykosidische Gruppe. Somit kann dieser nur in Ringform vorliegen. Die $\ce{CHO}$-Gruppe ist also gebunden. Saccharose ist somit nicht reduzierend.
Damit die Fehling-Probe mit Saccharose positiv ausfällt, muss erst eine saure Hydrolyse durchgeführt werden. Nach anschließender Neutralisation kann dann Fehling-Reagenz hinzugegeben werden und man erhält einen rot-braunen Niederschlag. Zurückzuführen ist das Ergebnis auf die Glucose-Bausteine, welche offenkettig vorliegen können und somit eine zugängliche Aldehyd-Gruppe besitzen.

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
9'178
sofaheld-Level
6'600
vorgefertigte
Vokabeln
7'642
Lernvideos
35'607
Übungen
32'354
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation


 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?














