Pyranosen und Furanosen

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Pyranosen und Furanosen
In diesem Video geht es um die Einteilung von Monosacchariden in Pyranosen und Furanosen. Dazu werden die beiden Grundbausteine dieser Substanzklassen erklärt und mit den wichtigsten Beispielen (Glucose und Fructose) verdeutlicht.
Transkript Pyranosen und Furanosen
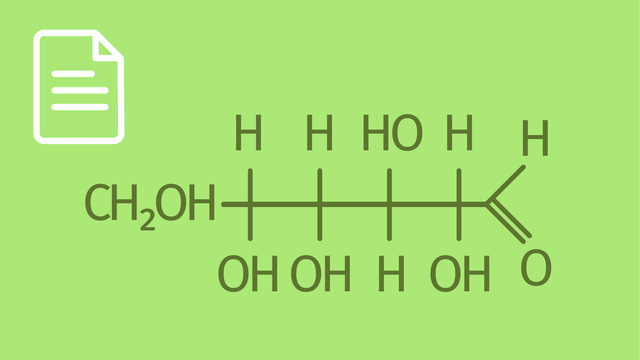
Guten Tag und herzlich willkommen. In diesem Video geht es wieder um Monosaccharide, und zwar um Pyranosen und Furanosen. Für das Verständnis des Videos sind folgende Vorkenntnisse von Vorteil: Ihr solltet wissen, was Monosaccharide sind. Ihr solltet Monosaccharide molekular als Kette und Ring kennen. Ihr solltet wissen, dass Monosaccharide isomer als Anomere auftreten. Ihr solltet die Darstellungen der Monosaccharide in Fischer-Projektion und als Haworth-Formel kennen. Ihr solltet wissen, was Konstitutionsisomere sind. Ziel des Videos ist es, Euch die Vielfalt der Ringstrukturen der Monosaccharide zu verdeutlichen. Ich habe den Film in 5 Abschnitte unterteilt. 1. Pyranring und Furanring 2. D-Glucose 3. Epimere der D-Glucose 4. D-Fructose 5. Zusammenfassung 1. Pyranring und Furanring Vielleicht erinnert Ihr Euch noch an die Heterozyklenchemie und an die Strukturformel des Pyrans. In Skelettschreibweise sieht das Pyranmolekül so aus. Obwohl in der Zuckerchemie von Pyranringen gesprochen wird, geht es eigentlich um die Grundstruktur des Tetrahydropyrans. Man kann die Strukturformel des Tetrahydropyrans so drehen, dass das Sauerstoffatom eine andere Stellung einnimmt. Man erhält die Haworth-Formel. Die Verstärkung der Bindungen vorne bedeutet, dass diese Seite zum Betrachter zeigt. Vielleicht erinnert Ihr Euch auch an die Struktur des Furans. Wir haben darüber gesprochen, als es um Aromaten ging. In Skelettschreibweise sieht das Molekül so aus. Obwohl die Zuckerchemiker den Namen Furanose benutzen, werden wir sehen, dass es sich eigentlich um den Tetrahydrofuran-Ring handelt. Die Doppelbindungen verschwinden und wir erhalten das Tetrahydrofuran-Molekül in Skelettschreibweise. In der Zuckerchemie wird das Sauerstoffatom dann oben angeordnet. Nach Vergrößerung der räumlichen Vorderseite erhält man die entsprechende Haworth-Formel. 2. D-Glucose Zunächst möchte ich das Molekül der D-Glucose so zeichnen, wie es gerade im Begriff ist, einen Ring zu bilden. In Stellung 1 befindet sich die Aldehydgruppe. In Stellung 6 die Hydroxymethylgruppe. Die Hydroxygruppen zeigen in den Stellungen 2, 4 und 5 nach unten, in Stellung 3 nach oben. Die Acetalysierung erfolgt durch die alkoholische Gruppe in 5-Stellung mit der Aldehydgruppe in 1. Dafür ist eine Drehung um die 4/5 Bindung notwendig. Die untere Darstellung zeigt die nach wie vor offenkettige Verbindung der D-Glucose - aber schon in günstiger Stellung, wie sie gerade im Begriff ist, ein intramolekulares Halbacetal zu bilden. Die Hydroxymethylgruppe 6 zeigt hier nach oben. Bei den Molekülen oben wie unten, handelt es sich um identische Verbindungen. Nun wird der Ring geschlossen. Die Kette befindet sich im Gleichgewicht mit zwei isomeren Verbindungen. Während ich zeichne, seht Ihr, dass die Struktur beider Moleküle zunächst völlig gleich ist. Nur in Stellung 1, am sogenannten anomeren Kohlenstoffatom, ist die Stellung der Hydroxygruppe unterschiedlich. Links zeigt die Hydroxygruppe nach unten, während sie rechts nach oben zeigt. Links hat sich Alpha-D-Glucose gebildet. Rechts handelt es sich um Beta-D-Glucose. Aber ein Detail stimmt nicht. Schaut Euch die Moleküle an. Es fehlt noch das Sauerstoffatom im Ring. Es fehlt noch das Sauerstoffatom im Ring. Es ist das Sauerstoffatom, das aus der alkoholischen Gruppe am Kohlenstoffatom 5 stammt. Und nun sind beide Moleküle korrekt dargestellt. Aus Abschnitt 1 wissen wir, warum die Verbindung links mit dem Oberbegriff "Pyranose" versehen wird und ebenso verhält es sich mit der Verbindung rechts. Auch sie ist eine Pyranose. 3. Epimere der D-Glucose Könnt Ihr Euch daran erinnern, was Epimere sind? Richtig. Epimere sind Monosaccharide, die sich nur an einem einzigen chiralen Zentrum unterscheiden. Wenn das für die Kette gilt, so muss das auch für den Ring richtig sein. Ein Epimeres zur Alpha-D-Glucose ist die Alpha-D-Mannose. Seht Ihr den einzigen Unterschied? Richtig. Dort, wo die Hydroxygruppe orange eingefärbt ist, am 2. Kohlenstoffatom, unterscheiden sich Alpha-D-Glucose und Alpha-D-Mannose. Ein weiteres Epimer der Alpha-D-Glucose ist die Alpha-D-Galactose. Alpha-D-Glucose und Alpha-D-Galactose sind epimer am Kohlenstoffatom 4, hier hellblau gekennzeichnet. Bei Alpha-D-Glucose kann man von einer D-Glucopyranose sprechen. Alpha-D-Mannose ist eine D-Mannopyranose und Alpha-D-Galactose ist eine D-Galactopyranose. 4. D-Fructose Die D-Fructose ist eine Ketose. In Fischer-Projektion wird sie so dargestellt. Die Nummerierung erfolgt von oben nach unten, von 1 bis 6. Eine Möglichkeit ist ein Ringschluss zum Sechsring, links oben. Eine weitere Möglichkeit ist der Ringsschluss zu einem anderen Sechsring, links unten. Habt Ihr erkannt, wodurch sich beide Verbindungen voneinander unterscheiden? Richtig. Es ist die Stellung der Hydroxygruppe in Position 2 am anomeren Kohlenstoffatom. Sie zeigt im oberen Molekül nach oben. Wir haben es also mit einer Beta-D-Fructopyranose zu tun. Das Molekül unten ist eine Alpha-D-Fructopyranose. Die Hydroxygruppe am anomeren Kohlenstoffatom 2 zeigt hier nämlich nach unten. Neben dem Ringschluss zum Sechsring zur Pyranose ist auch ein Ringschluss zum Fünfring, zur Furanose möglich. Die Hydroxygruppe zeigt am anomeren Kohlenstoffatom C2 nach oben. Daher ist es eine Beta-D-Fructofuranose. Der Fünfring rechts unten unterscheidet sich von der Verbindung darüber nur durch die Stellung der Hydroxygruppe am anomeren Kohlenstoffatom. Entsprechend befindet sich die Hydroxy-Methylgruppe auf der entgegengesetzten Seite. Somit handelt es sich hier um eine Alpha-D-Fructofuranose. 5. Zusammenfassung Monosaccharide bilden gerne Ringe. Dabei entstehen Sechsringe, sogenannte Pyranosen, und Fünfringe, sogenannte Furanosen. Die Monosaccharide Glucose, Mannose, Galactose und Fructose bilden Sechsringe. Fructose bildet darüber hinaus noch einen Fünfring. Die Stellung der Hydroxygruppe am anomeren Kohlenstoffatom kann unterschiedlich sein. Zeigt die Hydroxygruppe nach unten, so hat man es mit dem Alpha-Anomer zu tun. Weist die Hydroxygruppe nach oben, so ist es das Beta-Anomer. Ich danke für die Aufmerksamkeit. Alles Gute. Auf Wiedersehen.
Pyranosen und Furanosen Übung
-
Bestimme die Grundbausteine der Monosaccharide.
TippsErinnere dich an die Bedeutung des Wortes hydro.
Gesättigte Moleküle besitzen mehr Wasserstoffatome als ungesättigte Moleküle.
LösungVerbindungen mit Doppelbindungen werden vom Luftsauerstoff angegriffen. Den Zuckern kann bei Raumtemperatur so etwas nicht passieren. Das bedeutet, ihre Hauptbestandteile sind „gesättigte" Moleküle, bei denen alle Doppelbindungen hydriert sind. Es handelt sich um „Hydro"-Verbindungen.
Lösung: Tetrahydropyran und Tetrahydrofuran
Wie man schön sieht, sind die Bezeichnungen Pyranose und Furanose alles andere als korrekt. Im Unterschied zur Mathematik kommt so etwas häufig vor. Man will hier Vereinfachungen anstreben. Wenn es dabei nicht zu Verwechslungen kommt, ist das durchaus legitim.
-
Beschreibe die Ringbildung von D-Glucose.
TippsDer Start beginnt mit der einfacheren Struktur.
Nicht jede Konformation ist für die Reaktion geeignet.
Der Ring der D-Glucose ist ein intramolekulares Reaktionsprodukt eines Aldehyds mit einem Alkohol.
Die Reaktionsprodukte sind sich sehr ähnlich. Sie besitzen gleiche Summenformeln.
LösungDie Kette besitzt verschiedene reaktive Zentren. Eines ist die Aldehyd-Gruppe -CHO in Stellung 1. Die anderen reaktiven Zentren sind die Hydroxy-Gruppen -OH. Die Hydroxy-Gruppe in 5-Stellung ist für eine Reaktion besonders günstig, weil sich anschließend ein sehr stabiler Sechsring bildet. Das geschieht durch intramolekulare Acetalisiering. Dabei wandert das Wasserstoff-Atom von der 5-Hydroxy-Gruppe zur Aldehydgruppe. Das 5-Sauerstoff-Atom bildet mit dem 1-Kohlenstoff-Atom eine neue kovalente chemische Binding aus. Es entsteht ein Halbacetat. Dabei bilden sich zwei Isomere (Anomere); α-D-Glucose und und β-D-Glucose.
-
Bestimme alle möglichen Isomere der Fructose.
TippsFructose kann als Kette auftreten.
Durch Ringschluss kann die Kette der Fructose einen Ring bilden.
Als Ringe sind sowohl Pyranosen als auch Furanosen möglich.
Für jede Ringform sind jeweils zwei Anomere möglich.
LösungWir haben die Kette zu zählen. Daraus können durch Ringschluss eine Pyranose oder eine Furanose entstehen. Jeder der Ringe bildet jeweils zwei Anomere; das α-Isomer und das β-Isomer. Zusammen sind das fünf isomere Verbindungen. Im Video wurde eine Übersicht für D-Fructose gegeben. Analog kann man fünf Isomere für L-Fructose angeben. In der Summe ergibt das 10 Isomere.
-
Erkenne die Merkmale von Kette und Ring der D-Glucose.
TippsNur in einem Fall findet man eine Aldehyd-Gruppe -CHO vor.
Chiralitätszentren sind bei unseren Molekülen asymmetrische Kohlenstoff-Atome, also solche, die vier verschiedene Substituenten haben.
Die Aldehyd-Gruppe reduziert.
Ein Halbacetal ist halb Ether, halb Alkohol.
LösungDie Kette hat sechs Kohlenstoff-Atome und besitzt daher ein Hexan-Gerüst. Im Ring ist die Pyranose-Struktur vorgezeichnet. Der Ring ist ein Aldehyd und kann daher reduzieren. Die Kette hat ein chirales Zentrum weniger als der Ring, und zwar vier. Der Ring enthält eine Ether-Bindung -O-. In Nachbarschaft dazu befindet sich eine Hydroxy-Gruppe. Damit erhält man ein Halbacetal.
-
Finde die Epimerenpaare.
TippsErinnere dich, was der Begriff Epimere ausdrückt.
Die Moleküle von Mannose und Glucose unterscheiden sich durch verschiedene Stellungen einer funktionellen Gruppe an einem bestimmten Kohlenstoff-Atom.
Die Moleküle von Galactose und Glucose unterscheiden sich durch verschiedenen Stellungen einer funktionellen Gruppe an einem bestimmten Kohlenstoff-Atom.
Glucose und die beiden zu ihr epimeren Verbindungen bilden Sechsringe.
LösungDas Kriterium der Unterscheidung zweier Epimere sind verschiedene Stellungen der Hydroxy-Gruppe an einem einzigen chiralen Zentrum. Ist das Stellung 2, heißt das zur α-D-Glucose epimere Monosaccharid α-D-Mannose. Falls in Stellung 4 ein Unterschied vorliegt, spricht man von α-D-Galactose. Es handelt sich um Stereoisomere. Da alle drei Verbindungen Pyranosen sind, sagt man auch D-Glucopyranose, D-Mannopyranose und D-Galactopyranose.
-
Bestimme die Zahl der Chiralitätszentren in der Kette der D-Fructose.
TippsNur verschiedene Substituenten erfüllt die Bedingung für die Chiralität nicht.
Wo die Keto-Gruppe sitzt, kann kein Chiralitätszentrum sein.
Chiralität hat mit der Ausrichtung eines einzigen Restes nichts zu tun.
Notwendig und hinreichend für die Existenz eines gesättigten assymetrischen Kohlenstoff-Atoms (Chiralitätszentrum) ist die Bedingung, dass es vier unterschiedliche Substituenten hat.
LösungEgal, wie die Kohlenstoff-Kette beschaffen ist: Ein Chiralitätszentrum liegt vor, wenn das Kohlenstoff-Atom asymmetrisch ist. Das bedeutet, dass es vier verschiedene Substituenten hat. Zur Erklärung: Ein Substituent ist nicht nur ein Bindungsatom in Nachbarschaft. Es ist der gesamte Rest, der mit dem Kohlenstoff-Atom verbunden ist.
- 1 und 6 scheiden aus, da jeweils zwei Wasserstoff-Atome damit verknüpft sind.
- 2 ist ebenfalls nicht chiral, da C=O gedacht zwei gleiche Substituenten O bedeutet.
- 3, 4 und 5 sind chiral.
- Exemplarische Erklärung für 5: -OH, -H, Hydroxymethyl und der große Rest oben sind die vier verschiedenen Substituenten.

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
9'178
sofaheld-Level
6'600
vorgefertigte
Vokabeln
7'642
Lernvideos
35'607
Übungen
32'360
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation




 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?









Und 2te Frage: Ab Minute 6:09. Wo kommt bei der Schließung der D-Fructose zu einem Ring, die Oh-Gruppe am 2ten C-Atom her? In der Fischerprojektion sehe ich beim 2ten C-Atom nur ein doppelgebundenes Sauerstoffatom. Danke
Hallo Herr Otto. Wie meinen sie folgenden Satz in Minute 2:58 "Dafür ist eine Drehung um die 4-5 Bindung notwendig"..Was ist mit Drehung gemeint?
ENDLICHHH!!! habe ich es verstanden :D