Glucose – Kette oder Ring?

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Glucose – Kette oder Ring?
In diesem Video geht es um die beiden wichtigen Formen der Glucose - Kette und Ring. Zuerst wird gezeigt wie sich aus der Kettenform die Ringform bildet und wie man die Haworth-Formel für die Glucose aufschreiben kann. Im Anschluss wird dann auf die beiden Anomere der Glucose und die Mutarotation eingegangen.
Transkript Glucose – Kette oder Ring?
Guten Tag und herzlich willkommen! In diesem Video geht es um: "Glucose - Kette oder Ring?" Als Vorkenntnisse für diesen Film solltet Ihr unbedingt mitbringen: Wissen über Monosaccharide wie Glucose, die Konfiguration von Monosacchariden und den Begriff der Struktur im Zusammenhang mit Ihnen. In diesem Film möchte ich Euch wichtige Vorstellungen über die Struktur der Glucose vermitteln. Der Film ist in fünf Abschnitte gegliedert.
- Acetalisierung
- Haworth-Formel und FLOH-Regel
- Anomere
- Mutarotation
Zusammenfassung
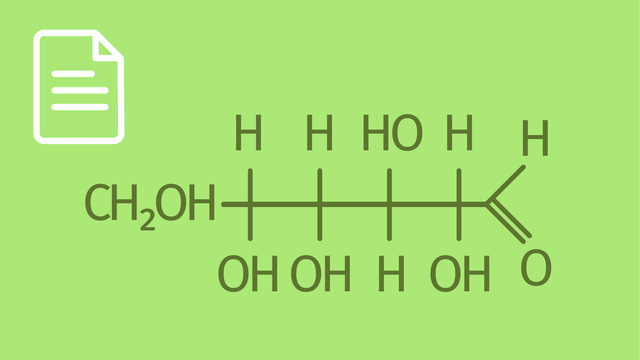
Acetalisierung. Erinnern wir uns daran, wie wir das Glucosemolekül in Fischerprojektion dargestellt haben. Das Glucosemolekül enthält eine Aldehydgruppe und alkoholische Gruppen. Wir wissen außerdem, dass Aldehyde und Alkohole zur Acetalisierung befähigt sind. Tatsächlich kann das Glucosemolekül eine intramolekulare Acetalisierung eingehen. Aber welche OH-Gruppe reagiert mit der Aldehydgruppe? Wir nummerieren die Kohlenstoffatome des Moleküls von oben nach unten durch. Für unsere Betrachtung wichtig sind die Kohlenstoffatome, die wir mit den Ziffern 2, 3, 4 und 5 belegt haben. Man kann vermuten, dass das Sauerstoffatom, was am Kohlenstoffatom 5 sitzt, für die Acetalisierung verantwortlich ist. Das kann man daraus ableiten, weil sich im Ergebnis dieser Reaktion ein Sechsring bildet. In diesem Sechsring ist ein Kohlenstoffatom durch ein Sauerstoffatom ersetzt, doch die Analogie zum Cyclohexanmolekül, über das wir bereits gesprochen haben, fällt sofort ins Auge. Somit findet eine intramolekulare Acetalisierung statt. Das H-Atom der Hydroxy-Gruppe, am Kohlenstoffatom 5, wandert zum Carbonylsauerstoffatom. Das Sauerstoffatom am Kohlenstoffatom 5 verbindet sich mit dem Kohlenstoffatom Nummer 1. Es ist ein Ring entstanden! Das Glucosemolekül kommt sowohl als Kette als auch als Ring vor. Die Ringform ist häufiger als die Kettenform.
Haworth-Formel und FLOH-Regel Die Ringform des Glucosemoleküls in Fischerprojektion ist zwar suggestiv, doch geometrisch unschön. Deswegen verwendet man die sogenannte Haworth-Formel. Rechts. Bei der geometrischen Übertragung kann es zu Problemen kommen. Wo soll ich die Hydroxy-Gruppe anordnen? Oben oder unten? Dafür bedient man sich der sogenannten FLOH-Regel. Diese besagt: Fischer links, oben Haworth oder Haworth oben. Kohlenstoffatom zwei hat die Hydroxy-Gruppe rechts, das bedeutet: Haworth unten! Kohlenstoffatom zwei hat die Hydroxy-Gruppe rechts, das bedeutet: Haworth oben!Kohlenstoffatom zwei hat die Hydroxy-Gruppe rechts, das bedeutet: Haworth unten! Die Hydroxymethyl-Gruppe schreibt man in der Haworth-Formel oben. Das solltet und müsst Ihr Euch merken. Wenn die Hydroxy-Gruppe in Stellung eins nach unten zeigt, spricht man von alpha-D-Glucose.
Anomere Ich möchte nun die Struktur eines Glucosemoleküls links aufzeichnen. Es stimmt mit dem Glucosemolekül rechts völlig überein, bis auf ein einziges Detail. Es ist nämlich die Stellung des Hydroxy-Gruppe am Kohlenstoffatom 1. Wenn dort die Hydroxy-Gruppe nach unten zeigt, so spricht man von alpha-D-Glucose. Zeigt die Hydroxi-Gruppe jedoch nach oben, so handelt es sich um beta-D Glucose. alhpa-D-Glucose und Bbeta-D Glucose sind sogenannte Anomere. Das C1 Kohlenstoffatom ist das anomere Kohlenstoffatom.
- Mutarotation Sowohl beta-D-Glucose als auch alpha-DGlucose verfügen über chirale Zentren, das heiß es handelt sich um optisch aktive Verbindungen. Das möchte ich mit den Sternchen an den Strukturformeln verdeutlichen. Beide Moleküle verhalten sich zueinander nicht wie Bild und Spiegelbild. Das heißt, es sind keine Enantiomere. Wenn alpha-D-Glucose in wässrige Lösung gebracht wird, so stellt sich über die Kette ein chemisches Gleichgewicht mit der beta-D-Glucose ein. Da beide Verbindungen optisch aktiv sind, kann man auch ihren spezifischen Drehwinkel im Wasser messen. Bei alpha-D-Glucose beträgt dieser Drehwinkel +112°. Bei beta-D-Glucose +19°. Bei der Umwandlung von alpha-D-Glucose zu beta-D-Glucose bis zur Einstellung des chemischen Gleichgewichts ändert sich der resultierende Drehwinkel der Lösung. Man erhält schließlich +53°. Dadurch lässt sich ein Gleichgewichtsverhältnis von 36 % alpha-D-Glucose zu 64 % beta-D-Glucose errechnen. Die Messung erfolgt mit monochromatischem polarisiertem Licht, der D-Linie des Natriums. Die Umwandlung von alpha-D-Glucose zu beta-D-Glucose und Einstellung des entsprechenden Gleichgewichts bezeichnet man als Mutarotation.
- Zusammenfassung Die Kettenform des Glucosemoleküls ist zur intramolekularen Acetalisierung befähigt. Der Ring des Glucosemoleküls ist in Fischer-Projektion nicht sehr anschaulich darstellbar. Daher verwendet man die sogenannte Haworth-Formel. Um die Anordnung der Hydroxy-Gruppen in den Stellungen 2, 3, 4 zu erkennen, verwendet man die FLOH-Regel. Fischer links, oben Harworth. Wenn die rot makierte Hydroxy-Gruppe nach unten zeigt, so spricht man von alpha-D-Glucose. Weist die Hydroxy-Gruppe, jedoch nach oben, jetzt orangefarben markiert, so spricht man von beta-D-Glucose. Bei alpha- und beta-D Glucose handelt es sich um, sogenannte Anomere. Die Umwandlung des alpha-Anomeres in das beta-Anomer in wässriger Lösung bis zur Einstellung des chemischen Gleichgewichtes bezeichnet man als Mutarotation. Die spezifische Drehung der alpha-D-Glucose beträgt 112°. Die spezifische Drehung der beta-D-Glucose beläuft sich auf +19°. Bei der Einstellung des Gleichgewichts zwischen beiden Anomeren erhält man einen Wert von +53°. Daraus lassen sich die Anteile von alpha-D-Glucose und beta-D-Glucose bei Einstellung des chemischen Gleichgewichts berechnen. Diese betragen: Für die alpha-Form 36% und für die beta-Form 64 %. Ich danke für die Aufmerksamkeit, alles Gute! Auf Wiedersehen!
Glucose – Kette oder Ring? Übung
-
Benenne die Funktionalitäten der D-Glucose.
TippsEine sekundäre Hydroxygruppe sitzt an einem C-Atom, welches nur noch ein H-Atom und zwei weitere Alkylreste trägt.
LösungObiges Bild zeigt die Mutarotation der Glucose im wässrigen Medium. Die Mutarotation bezeichnet, dass in wässriger Form die $\alpha$- und $\beta$-D-Glucose im Gleichgewicht vorliegen. Dieses Gleichgewicht kann über ein Polarimeter bestimmt werden, da beide chiralen Substanzen das linear polarisierte Licht um verschiedene Winkel drehen.
Ursache für die Mutarotation ist, dass die cyclische und die offenkettige Form im Gleichgewicht stehen. Da die Aldehyd-Funktionalität wegen des $sp^2$-Charakters planar ist, kann die Hydroxygruppe entweder oberhalb der entstehenden Ringebene oder unterhalb davon angreifen. Diese Unterschiede führen zur $\alpha$- und der $\beta$-Form, wobei in der $\alpha$-Form die glycosidische Hydroxygruppe unterhalb der Ringebene liegt.
Die glycosidische Hydroxygruppe ist keine „normale“ sekundäre Hydroxygruppe, sondern sie gehört zur Struktureinheit des Halbacetals. Diese Gruppe ermöglicht mit Alkoholen jeglicher Art, ein Vollacetal zu bilden. Dies ist vergleichbar mit der Reaktion von einem Aldehyd mit einem Diol.
Darüber hinaus verfügt der Zucker sowohl in der Kette als auch im Ring über eine primäre Hydroxygruppe, die an einer $-CH_2$-Gruppe sitzt, und mehrere sekundäre Hydroxygruppen, die an den vierfach verzweigten Kohlenstoffatomen sitzen. Diese sind Chiralitätszentren (vier verschiedene Substituenten an einem Kohlenstoffatom).
-
Erkläre die Acetalisierung der Glucose.
TippsViele natürliche Substanzen liegen in Sechsringen vor, da in diesen eine sehr kleine Ringspannung herrscht.
LösungDie Acetalisierung von Zuckern ist eine intramolekulare Reaktion, d.h. sie erfolgt zwischen den Gruppen eines Moleküls. Eine Acetalisierung ist die Reaktion zwischen einem Aldehyd und einem Alkohol. Beim Zucker ist eine Besonderheit, dass die Acetalisierung bei dem Halbacetal stoppt, deswegen ist die aus der Carbonylgruppe gebildete Hydroxygruppe sehr reaktiv und geht andere Reaktionen ein als die restlichen Hydroxygruppen. So reagiert sie z.B. sofort bei Zugabe eines Alkohols zum Vollacetal. Diese Hydroxygruppe wird auch glycosidische Hydroxygruppe genannt. Bei der Acetalisierung laufen folgende Schritte ab:
- Protonierung der Carbonylfunktion (orange) durch die Hydroxygruppe am C5-Kohlenstoffatom.
- Umlagerung des Kations zur Bildung eines Carbokations.
- Angriff des Sauerstoffatoms vom C5-Kohlenstoffatom auf das Carbokation (C1-Position) und Bildung eines Halbacetals (grün).
-
Beschreibe das Gleichgewicht zwischen den zwei anomeren Formen der Zucker.
TippsNur bestimmte Zentren aus einem Molekül sorgen dafür, dass linear polarisiertes Licht gedreht wird. Wie heißen diese und worin unterscheiden sich die $\alpha$- und $\beta$-Form der Zucker?
Chirale Zentren, die vier verschiedene Substituenten tragen, sorgen für optische Aktivität.
LösungAls Anomere werden in der Zuckerchemie besondere Isomere bezeichnet. Anomere sind Stoffe, die sich in ihrer Konfiguration nur am anomeren Kohlenstoffatom unterscheiden. Dieses umfasst damit die $\alpha$- und $\beta$-Formen der Zucker.
Obiges Bild zeigt die Mutarotation der Glucose im wässrigen Medium. Die Mutarotation bezeichnet, dass in wässriger Form die $\alpha$- und $\beta$-D-Glucose im Gleichgewicht vorliegen. Dieses Gleichgewicht kann über ein Polarimeter bestimmt werden, da beide chiralen Substanzen das linear polarisierte Licht um verschiedene Winkel drehen.
Ursache für die Mutarotation ist, dass die cyclische und die offenkettige Form im Gleichgewicht stehen Da die Aldehyd-Funktionalität wegen des $sp^2$-Charakters planar ist, kann die Hydroxygruppe entweder oberhalb der entstehenden Ringebene oder unterhalb davon angreifen. Diese Unterschiede führen zu der $\alpha$- und der $\beta$-Form, wobei in der $\alpha$-Form die glycosidische Hydroxygruppe unterhalb der Ringebene liegt.
-
Bestimme die Fischer- und Haworth-Formeln folgender Zucker.
TippsFLOH: Fischer Links Oben Haworth
LösungDie beiden Zucker sind D-Galactose und D-Allose. Um ihre Fischer-Projektion in die Haworth-Schreibweise zu überführen, dient die FLOH-Regel (Fischer Links Oben Haworth). Nach dieser Regel stehen in der Haworth-Projektion die Wasserstoffatome und Hydroxygruppe oberhalb der Ringebene, die in der Fischer-Projektion links stehen und umgekehrt.
-
Identifiziere die $\beta$-Form der Glucose.
TippsDie $\beta$-Glucose entsteht, wenn die Hydroxygruppe bei der Acetalisierung von oben angreift.
Die $\beta$-Form der Glucose überwiegt in wässriger Lösung.
LösungAls Anomere werden in der Zuckerchemie besondere Isomere bezeichnet. Anomere sind Stoffe, die sich in ihrer Konfiguration nur am anomeren Kohlenstoffatom unterscheiden. Dieses umfasst damit die $\alpha$- und $\beta$-Formen der Zucker.
Ursache für die Bildung der beiden Anomere ist das planare, $sp^2$-hybridiserte Carbon-Kohlenstoffatom. Dadurch, dass es planar ist und nur drei verschiedene Substituenten trägt, ist es nicht chiral. Ein Angiff der Hydroxygruppe kann unterhalb oder oberhalb der Ebene erfolgen, die durch die $-C=O$-Bindung aufgespannt wird. Je nach der Angriffsseite entstehen zwei stereochemisch differenzierte Konfigurationen. Solche Zentren werden auch prochirale Zentren genannt.
Die $\beta$-Form entsteht, wenn die Hydroxygruppe vom fünften C-Atom von oben auf die Aldehydgruppe angreift. Die entstandene Hydroxygruppe befindet sich dann oberhalb der Ringebene. In wässriger Lösung wird diese Form aufgrund von günstigen Wechselwirkungen mit dem polaren Wassermolekül begünstigt.
-
Beweise, dass auch die Kettenform des Zuckers im Gleichgewicht vorliegt.
TippsDie dritte Reaktion wird auch Silberspiegelprobe genannt.
LösungDer hauptsächliche Unterschied von der Kettenform zur Ringform ist, dass bei der Kettenform eine Aldehyd-Gruppe als reaktive, funktionelle Gruppe vorliegt. In der Kettenform liegt diese als Halbacetal umgeformt vor.
Reaktionen, die zum Nachweis des Aldehyd-Charakters von Zuckern dienen, sind die Silberspiegelprobe und die Fehling-Probe.
- Die Silberspiegelprobe erfolgt mit dem Tollens-Reagenz (ammoniakalische Silbernitratlösung), wobei durch den Aldehyd die Silber(I)-Ionen zu metallischem Silber reduziert werden, welches sich als Spiegel an der Reagenzglaswand abscheidet.
- Die Fehling-Probe erfolgt mit der Fehling-I-Lösung (Kupfer(II)-sulfat) und der Fehling-II-Lösung (Kaliumnatriumtartrat) im Basischen. Bei dieser Reaktion werden durch die Aldehyd-Gruppe die Kupfer(II)-Ionen zu Kupfer(I)-Ionen reduziert, die als ziegelrotes Kupfer(I)-oxid einen Niederschlag bilden.

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
9'178
sofaheld-Level
6'600
vorgefertigte
Vokabeln
7'642
Lernvideos
35'607
Übungen
32'360
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation




 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?












Super hilfreiches Video. Vielen dank :)
Fein.
doch nicht hab vergessen das das H wandert. sry
ich glaube bei 3:53 ist ein Fehler beim Glucose Molekül beim ersten Kohlenstoffatom bei Fischer.
dake ,super vidoe !