Halbacetal- und Acetalbildung
Tauche ein in die Welt der Halbacetale und Acetale! Wenn Aldehyde auf Alkohole stoßen, entsteht Chemie. Erfahre was Halbacetale und Acetale genau sind, wie sie entstehen und welche Rolle sie in unserem täglichen Leben einnehmen. Neugierig? Erfahre mehr im Text!

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Halbacetal- und Acetalbildung
Halbacetal- und Acetalbildung – Chemie
Wusstest du, dass Aldehyde und Alkohole chemisch miteinander reagieren? Dabei entstehen neue Verbindungsklassen: Halbacetale und Acetale. Was das ist und wie sie genau entstehen, erfährst du in diesem Text.
Was sind Halb- und Vollacetale? – Definition
Einfach erklärt ist ein Halbacetal ein Zwischenprodukt der Acetalbildung und ist durch eine Hydroxygruppe ($\ce{-OH}$) und eine Alkoxygruppe ($\ce{-OR}$) am selben Kohlenstoffatom gekennzeichnet. Bei der Alkoxygruppe handelt es sich um eine funktionelle Gruppe, bei der ein Sauerstoffatom $(\ce{O})$ mit einer Alkylgruppe verbunden ist.
Und was ist ein Vollacetal? Einfach erklärt besitzt ein Vollacetal oder Acetal an einem Kohlenstoffatom zwei Alkoxygruppen ($\ce{-OR}$). Bei der Bildung von Acetalen entstehen als Zwischenprodukte zuerst Halbacetale, die in Anwesenheit von Säuren weiter zu Acetalen reagieren.
Der Unterschied zwischen einem Halbacetal und einem Acetal besteht also darin, dass das Acetal zwei Alkoxygruppen an einem Kohlenstoffatom und das Halbacetal eine Alkoxy- und eine Hydroxygruppe besitzt. Dabei sind beide Verbindungen, also sowohl das Acetal als auch das Halbacetal, stabil.
Wie bildet sich ein Halbacetal?
Der Mechanismus der Halbacetalbildung wird dir im Folgenden vorgestellt. Beachte bitte, dass alle Reaktionsschritte umkehrbar sind.
| 1. Protonierung der Carbonylgruppe des Aldehyds unter Säurekatalyse: | Das Proton aus der Säure bildet mit einem der ungepaarten Elektronen der Carbonylgruppe eine kovalente Bindung aus. Es überträgt seine positive Ladung dann auf das Sauerstoffatom. Es ist möglich, dass das eine Elektronenpaar der Doppelbindung zum Sauerstoffatom umklappt und zum nicht bindenden Elektronenpaar wird. Die positive Ladung verschiebt sich dann vom Sauerstoffatom zum Kohlenstoffatom und damit entsteht ein Carbeniumion. |
| 2. Addition eines Alkohols: nukleophiler Angriff | Alkohole sind aufgrund der nicht bindenden Elektronenpaare am Sauerstoff nucleophil. Daher reagiert ein Alkoholmolekül mit dem entstandenen Carbeniumion. Dadurch kommt es zur Ausbildung einer kovalenten Bindung und die positive Ladung befindet sich nun am Sauerstoffatom des ehemaligen Alkoholmoleküls. Es hat sich ein sogenanntes Oxoniumion gebildet. |
| 3. Deprotonierung unter Abspaltung eines Protons: | Vom entstandenen Oxoniumion spaltete sich nun das Proton ab. Die so entstandene Verbindung wird Halbacetal genannt. |
Im folgenden Bild ist ein Reaktionsschema zur Bildung eines Halbacetals zu sehen:
Wie bildet sich ein (Voll-)Acetal?
Der Mechanismus der Acetalbildung wird dir im Folgenden vorgestellt. Das Halbacetal reagiert mit einem Alkohol in Anwesenheit von Säuren weiter zu einem Acetal. Alle Reaktionsschritte sind umkehrbar.
- Protonierung der Hydroxygruppe des Halbacetals: Durch die Anlagerung des Protons entsteht wieder ein Oxoniumion.
- Dehydratisierung: Das Sauerstoffatom zieht die Elektronen vom Kohlenstoffatom an. Es spaltet sich Wasser ($\ce{H2O}$) ab. Es bleibt ein Carbeniumion zurück.
- Addition eines Alkohols durch einen nucleophilen Angriff einer Hydroxygruppe auf das positiv geladene Kohlenstoffatom. Es entsteht ein Oxoniumion.
- Deprotonierung unter Abspaltung eines Protons: Es entsteht ein Acetal.
In dem folgenden Bild kannst du die Reaktionsschritte zur Bildung eines Acetals sehen:
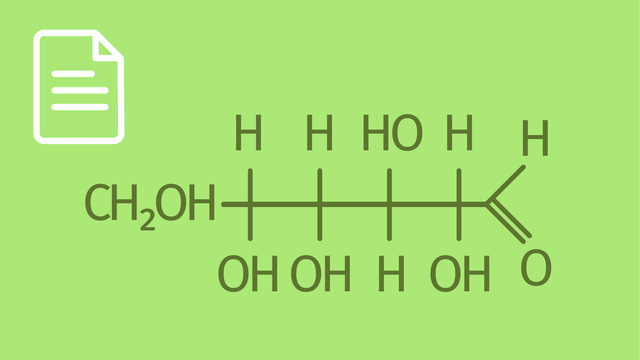
Halbacetalbildung am Beispiel von Glucose
Das Molekül Glucose existiert teilweise in Kettenform. Die Kohlenstoffatome nummeriert man, indem man mit der Aldehydgruppe beginnt. Aldehydzucker werden als Aldosen und Ketozucker als Ketosen bezeichnet. Glucose liegt sowohl im festen Zustand als auch in wässriger Lösung hauptsächlich in Ringform vor. Wie geschieht das?
Stell dir die Geometrie der Kette so vor, dass der Ring praktisch schon vorgebildet ist. Die Elektronen des Sauerstoffatoms vom fünften Kohlenstoffatom greifen das erste Kohlenstoffatom nucleophil an. Ein Elektronenpaar der Doppelbindung wird zum Sauerstoffatom der Aldehydgruppe verschoben. Dadurch entstehen eine positive Ladung am Sauerstoffatom des fünften Kohlenstoffatoms (also ein Oxoniumion) und eine negative Ladung am Sauerstoffatom des ersten Kohlenstoffatoms. Vom Oxoniumion wird nun ein Proton abgespalten. Die negative Ladung vereinigt sich mit einem Proton zu eine Hydroxygruppe.
Es hat also ein intramolekularer Ringschluss stattgefunden. Die cyclische Form der $\alpha$-D-Glucose ist somit ein Halbacetal. Zahlreiche Zucker gehören zu den Aldosen und liegen häufig als cyclische Halbacetale vor.
Die Halbacetalbildung am Beispiel der D-Altrose ist in der folgenden Abbildung dargestellt.
Verwendung von Halbacetalen und Acetalen – Beispiele
Man verwendet Halb- und Vollacetale als Lösungsmittel und Riechstoffe. Sie werden aufgrund ihres angenehmen Geruchs Spirituosen wie Rum, Arrak und Obstbrand als Bukettstoff zugesetzt.
In der Synthesechemie werden Acetale häufig als Schutzgruppen für Carbonylgruppen benutzt. Es reagiert z. B. ein Diol mit einer zu schützenden Carbonylgruppe in Gegenwart von Säuren. Das dabei gebildete cyclische Acetal ist chemisch relativ stabil, unter anderem gegenüber Basen und Reduktionsmitteln. Nach weiteren Syntheseschritten kann die Acetalgruppe wieder abgespalten werden. So wird verhindert, dass sich die Carbonylgruppe an den Reaktionen beteiligt.
Dieses Video
In diesem Video lernst du, was Halbacetale und Vollacetale sind. Die Reaktion von Alkoholen mit Aldehyden führt zu einem Halbacetal. Dieses reagiert mit einem Alkohol weiter zu einem Vollacetal. Du erfährst etwas über die Halbacetalbildung eines Glucosemoleküls und das Vorkommen der Acetale in der Synthesechemie oder in Spirituosen.
Im Anschluss an das Video und diesen Text findest du Übungsaufgaben zu den Halbacetalen und Vollacetalen, um dein erlerntes Wissen zu überprüfen. Viel Spaß!
Transkript Halbacetal- und Acetalbildung
Hallo und ganz herzlich willkommen! Aldehyde und Alkohole sind euch wohlbekannt. Ihr wisst gut, dass man sie ineinander umwandeln kann. Wusstet ihr aber auch, dass Aldehyde mit Alkoholen chemisch reagieren? Dabei entstehen zwei neue Verbindungsklassen: Halbacetale und Acetale. Dieses Video trägt den Namen "Halbacetal- und Acetalbildung". Aldehyd und Alkohol Mischt man ein Aldehyd mit einem Alkohol, so findet selbst bei Erwärmung keine Reaktion statt. Erinnern wir uns: Eine Carbonsäure reagiert mit einem Alkohol zu einem Ester nur dann, wenn eine Säure als Katalysator anwesend ist. Als Katalysator dienen Broenstedsäuren, häufig wasserfreie Schwefelsäure. Die katalytische Wirkung wird dabei von Protonen bewerkstelligt. Halbacetal Ein Aldehyd beginnt zu reagieren, sobald Protonen anwesend. 1. Schritt: Protonierung Das Proton bildet mit einem der ungepaarten Elektronen der Carbonylgruppe eine kovalente Bindung aus. Es überträgt seine positive Ladung auf das Sauerstoff - Atom. Es ist möglich, dass das eine Elektronenpaar der Doppelbindung zum Sauerstoff - Atom umklappt und zum nichtbindenden Elektronenpaar wird. Die positive Ladung verschiebt sich dann vom Sauerstoff - Atom zum Kohlenstoffatom. Es entsteht ein Carbenium - Ion. 2. Schritt: Nucleophiler Angriff Alkohole sind durch die nichtbindenden Elektronenpaare am Sauerstoff nucleophil. Daher reagiert ein Alkohol - Molekül mit dem entstandenen Carbenium - Ion. Es entsteht eine kovalente Bindung. Die positive Ladung sitzt nun am Sauerstoff - Atom des ehemaligen Alkohol - Moleküls. Es hat sich ein Oxonium - Ion gebildet. 3. Schritt: Deprotonierung Vom entstandenen Oxonium - Ion spaltete sich das Proton ab. Die entstandene Verbindung nennt man Halbacetal. Beachtet bitte: Alle drei Reaktionsschritte sind umkehrbar. Acetal
Ein Halbacetal reagiert mit einem Alkohol weiter. 1. Schritt: Protonierung der Hydroxy - Gruppe Durch die Anlagerung des Protons entsteht wieder ein Oxonium - Ion. 2. Schritt: Dehydratisiering Vom Oxonium - Ion wird ein Wasser - Molekül abgespalten. Es entsteht ein Carbenium - Ion. 3. Schritt: Nucleophiler Angriff Es erfolgt ein nucleophiler Angriff des Alkohol - Molekül auf das Carbenium - Ion. Es entsteht ein Oxonium - Ion. 4. Schritt: Deprotonierung Vom Oxonium - Ion wird ein Proton abgespalten. Es entsteht ein Molekül Acetal. Mitunter sagt man Vollacetal. Wie sind Halbacetale und Acetale chemisch einzuordnen? Schauen wir uns einmal ein Beispiel für ein Halbacetal an: Offensichtlich handelt es sich hier um einen Ether und einem Alkohol in einem Molekül. Oder einen "Etheralkohol". Was ist ein Acetal oder Vollacetal? Das ist ein zweifacher Ether. Halbacetale und Acetale sind stabile chemische Verbindungen.
Beachtet bitte: Die Sauerstoff - Atome sitzen am selben Kohlenstoff - Atom. Formal sind sie abgeleitet von so genannten geminalen Alkoholen. Diese allerdings sind instabil. Verwendung Acetale sind flüssig mit oft angenehmen Geruch. Man verwendet sie als Lösungsmittel und Riechstoffe. Sie werden Spirituosen wie Rum, Arrak und Obstbrand als Bukettstoff zugesetzt. In der Synthesechemie werden Acetale werden häufig als Schutzgruppen für Carbonyl-Gruppen benutzt. Es reagiert z. B. ein Diol mit einer zu schützenden Carbonyl-Gruppe in Gegenwart von Säuren. Das cyclische Acetal ist chemisch relativ stabil, u. a. gegenüber Basen und Reduktionsmitteln. Nach weiteren Syntheseschritten kann die Schutzgruppe wieder abgespalten werden. Der Überraschungsgast Ihr werdet es kaum glauben, aber es handelt sich um Traubenzucker, Glucose, genauer um D - Glucose. Das Molekül existiert teilweise in Kettenform. Die Kohlenstoff - Atome nummeriert man, beginnend mit der Aldehyd - Gruppe. Tatsächlich liegt die Glucose im festen Zustand als auch in wässriger Lösung hauptsächlich in Ringform vor. Was geschieht? Wir stellen uns die Geometrie der Kette so vor, dass der Ring praktisch schon vorgebildet ist. Die Elektronen des Sauerstoff - Atoms vom Kohlenstoff - Atom in 5 - Stellung greifen das 1 - Kohlenstoff - Atom nucleophil an. Ein Elektronenpaar der Doppelbindung wird zum Sauerstoff - Atom der Aldehyd - Gruppe verschoben. Im Ergebnis entstehen eine positive Ladung am Sauerstoff - Atom des 5 - Kohlenstoff - Atoms (also ein Oxonium - Ion) und eine negative Ladung am Sauerstoff - Atom des 1 - Kohlenstoff -Atoms. Vom Oxonium - Ion wird ein Proton abgespalten. Die negative Ladung vereinigt sich mit einem Proton zu eine Hydroxy - Gruppe. Wir stellen fest: Es hat ein intramolekularer Ringschluss stattgefunden. Die cyclische Form Form der alpha - D - Glucose ist ein Halbacetal.
Bemerkungen Zeigt -OH in der Darstellung bei 1 - C nach unten ist es alpha - D - Glucose. Zeigt -OH jedoch nach oben, ist es beta - D - Glucose. Glycoside sind Verbindungen der allgemeinen Struktur R-O-Z Dabei ist Z ein Zuckerrest (im Beispiel alpha - Glucose) R ist ein alkoholischer Rest. Für R wäre ein weiteres Molekül von alpha - D - Glucose denkbar. Es entsteht somit durch die Veretherung von zwei Molekülen ein Disaccharid. Dieses nennt man Maltose. Die Maltose verbindet beide Fragmente über die glycosidische Bindung -O-. Bei dem Molekül handelt es sich um ein Acetal oder Vollacetal. Und ganz zum Schluss Acetal ist ein Oberbegriff Werden Aldehyde verwendet, spricht man auch von Acetalen im engeren Sinne. Bei Verwendung von Ketonen sagt man mitunter Ketale. Das war es auch schon wieder für heute. Ich wünsche euch alles Gute und viel Erfolg. Tschüs Euer André
Halbacetal- und Acetalbildung Übung
-
Formuliere die Reaktionsschritte zur Bildung eines Halbacetals aus Ethanal und Ethanol.
TippsDer Katalysator ist das kleinste chemisch relevante Teilchen.
Beim Carbenium-Ion befindet sich die positive Ladung an einem Kohlenstoffatom, beim Oxonium-Ion befindet sich die positive Ladung an einem Sauerstoffatom.
Lösung1. Reaktion mit dem Katalysator
$CH_3CHO$ + $H^{\oplus}$ $\rightleftharpoons$ $CH_3C^{\oplus}H(OH)$
Als Katalysator wirkt hier ein Proton. Es reagiert mit dem Aldehyd und es entsteht ein Carbenium-Ion.
2. Reaktion mit dem Alkohol
$CH_3C^{\oplus}H(OH)$ + $C_2H_5OH$ $\rightleftharpoons$ $CH_3CH(OH)-O^{\oplus}(H)C_2H_5$
Das Carbenium-Ion reagiert mit einem Molekül des Ethanols zu einem Oxonium-Ion.
3. Rückbildung des Katalysators
$CH_3CH(OH)-O^{\oplus}(H)C_2H_5$ $\rightleftharpoons$ $CH_3CH(OH)-OC_2H_5$ + $H^{\oplus}$
Im letzten Schritt wird vom Oxonium-Ion ein Proton abgespalten. Es entsteht ein Molekül des Halbacetals.
-
Ermittle die Verbindungsklassen zu folgenden Verbindungen.
TippsEther und Ester solltest du zuerst an den funktionellen Gruppen erkennen.
Halbacetale kann man als Alkoholether auffassen, Acetale als Diether.
LösungHalbacetale
Diese Verbindungen sind durch die Gruppe $-CH(OH)O-$ gekennzeichnet:
- $CH_3CH(OH)OCH_3$,
- $C_2H_5CH(OH)OCH_3$,
- $CH_3CH(OH)OC_2H_5$.
Diese Verbindungen sind durch die Gruppe $-CH(O-R)_2-$ gekennzeichnet:
- $CH_3CH(OCH_3)_2$,
- $C_2H_5CH(OCH_3)_2$,
- $CH_3CH(OC_2H_5)_2$.
Diese Verbindungen sind durch die Sauerstoffbrücke $-O-$ gekennzeichnet:
- $CH_3OCH_3$,
- $CH_3OC_2H_5$,
- $C_2H_5OC_2H_5$.
Diese Verbindungen sind durch die Ester-Gruppe $-COO-$ gekennzeichnet:
- $HCOOCH_3$,
- $CH_3COOCH_3$,
- $CH_3COOC_2H_5$.
-
Leite die Eigenschaften des Dimethoxymethans her.
TippsPolarität bewirkt Anziehung zwischen den Teilchen.
Dimethoxymethan hat ähnliche Eigenschaften wie Diethylether. Sie sind nur noch etwas ausgeprägter.
LösungDimethoxymethan ist ein Acetal. Es kann durch eine Reaktion von Formaldehyd mit Methanol hergestellt werden. Das ist eine typische Acetalsynthese. Ein Molekül des Dimethoxymethans hat dabei die ungefähre Größe der Moleküle des Pentans und Dimethylethers.
Zwischen den Teilchen des Dimethoxymethan wirken keine Wasserstoffbrückenbindungen. Dafür fehlen die Wasserstoffatome an Sauerstoffatomen (Hydroxy-Wasserstoff) oder an Stickstoffatomen (Amino-Wasserstoff). Tatsächlich wirken die viel schwächeren Dipol-Dipol-Kräfte.
Dimethoxymethan ist nicht unbegrenzt mit Wasser mischbar. Das ist durch das Fehlen von Wasserstoffbrückenbindungen zwischen den Teilchen beider Verbindungen nicht möglich. Tatsächlich löst sich Dimethoxymethan begrenzt in Wasser (285 g/l).
Dimethoxymethan kann unmöglich eine Siedetemperatur von über 100 °C besitzen. Sie sollte vergleichbar mit den Werten von Pentan und Diethylether sein, die etwa 35 °C betragen. Man kann erwarten, dass Dimethoxymethan vielleicht noch etwas höher siedet, da das Molekül der Verbindung zwei Sauerstoffatome enthält. Dadurch ist die Polarität etwas höher im Vergleich zu Diethylether. Die Anziehung zwischen den Teilchen ist damit auch stärker. Die Siedetemperatur beträgt 42 °C.
-
Erkenne die Acetale unter den Verbindungen.
TippsEin Acetal erkennt man anhand eines bestimmten Strukturelements.
Acetale entstehen durch Reaktion von Vertretern zweier typischer Verbindungsklassen.
LösungEin Acetal ist formal der Diether eines 1,1-Alkohols. Beide Sauerstoffatome sitzen am selben Kohlenstoffatom. Damit muss das Strukturelement $-O-CH(R)-O-$ erkennbar sein. Ist es zu identifizieren, kann man die Verbindung als Acetal auffassen.
Erste Zeile von links nach rechts
- 1,4-Dioxan ist kein Acetal. Die Sauerstoffatome befinden sich an verschiedenen Kohlenstoffatomen.
- Dioxolan ist ein Acetal. Man kann sich die Verbindung als Reaktionsprodukt aus Formaldehyd $HCHO$ und Ethylenglycol $H-CH_2-CH_2-OH$ vorstellen.
- Trioxan kann man als Acetal auffassen. Es könnte aus Formaldehyd $HCHO$ und dem Alkohol $HO-CH_2-O-CH_2-O-CH_2-OH$ entstanden sein.
- Es handelt sich um ein organisches Peroxid. Das ist kein Acetal.
- Metaldehyd ist ein Acetal. Ein Molekül der Verbindung könnte aus zwei Molekülen Acetaldehyd $CH_3-CHO$ und aus zwei Molekülen des Alkohols $HO-CH(CH_3)-OH$ entstanden sein.
- Paraldehyd kann man ebenfalls als Acetal auffassen. Es könnte aus Acetaldehyd $CH_3-CHO$ und dem Alkohol $HO-CH(CH_3)-O-CH(CH_3)-OH$ entstanden sein.
-
Bestimme geeignete Edukte für die Herstellung von Acetalen.
TippsAcetale entstehen nur, wenn Verbindungen aus ganz bestimmten Verbindungsklassen miteinander reagieren.
Acetale entstehen nicht aus Verbindungen einer einzigen Verbindungsklasse.
LösungEin Acetal wird aus einem Aldehyd oder einem Keton und einem Alkohol hergestellt. Daher bilden folgende Verbindungen Acetale miteinander:
- Aldehyd und Alkohol: Ethanal $CH_3-CHO$ und Ethanol $CH_3CH_2-OH$,
- Keton und Alkohol: Aceton $CH_3-CO-CH_3$ und Propanol $CH_3CH_2-OH$,
- Keton und Alkohol: Aceton $CH_3-CO-CH_3$ und Butanol $CH_3CH_2CH_2CH_2-OH$.
Zwei Alkohole oder auch zwei Aldehyde untereinander bilden kein Acetal.
-
Entwickle einen Syntheseweg für ein Monoglycerid.
TippsZunächst müssen zwei benachbarte alkoholische Gruppen mit einer Schutzgruppe vor weiterer Reaktion bewahrt werden.
Die verbleibende alkoholische Gruppe wird zur Reaktion gebracht.
Die Schutzgruppe wird abgelöst und man erhält die gewünschte Verbindung.
LösungTriglyceride
Die Strukturbausteine der Triglyceride sind der Alkohol Glycerin und verschiedene Fettsäuren.
Monoglyceride
Es gibt zwei isomere Monoglyceride; die Verbindung kann in den Stellungen 1 und 2 substituiert werden. Stellung 3 entspricht der Stellung 1, weil das Glycerin-Molekül symmetrisch aufgebaut ist.
Synthese des Monoglycerids
Reaktion des Alkohols mit dem einfachsten Keton
Der Alkohol ist Glycerin, das einfachste Keton ist Aceton.
Glycerin + Aceton $\longrightarrow$ Acetalalkohol + Wasser
Acetalalkohol ist die Zwischenverbindung aus der Abbildung.
Veresterung der Zwischenverbindung
Der Acetalalkohol kann weiter reagieren.
Acetalalkohol + Fettsäure $\longrightarrow$ Acetalester + Wasser
Durch die eine verbliebene Hydroxy-Gruppe $-OH$ reagiert die Zwischenverbindung mit der Fettsäure, wobei ein Acetalester entsteht. Als Katalysator verwendet man eine starke Säure. Das entstehende Wasser wird sofort abgeführt.
Ablösung des Ketons unter sauren Bedingungen
Unter Zugabe von Wasser wird das Aceton im sauren Milieu abgelöst.
Acetalester + Wasser $\longrightarrow$ Monoglycerid + Aceton
Somit hat sich das gewünschte Reaktionsprodukt, das Monoglycerid, gebildet. Es kann leicht vom flüchtigen Aceton abgetrennt werden.

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
9'178
sofaheld-Level
6'600
vorgefertigte
Vokabeln
7'642
Lernvideos
35'607
Übungen
32'360
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation


 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?













Richtig gut!
Guten Abend Alli,
ich habe erst nicht verstanden, was du meinst.
Ich denke, hier gibt es nur ein Missverständnis.
1. Wenn wir bei beiden Molekülen von ACETAL sprechen, so ist jeweils das ursprüngliche C1 - Atom im LINKEN Monomer gemeint, wo sich die glykosidische Bindung befindet.
2. Betrachten wir das C - Atom GANZ RECHTS, so ist Maltose natürlich ein HALBACETAL, Saccharose in diesem Sinne "gar nichts". Aber das ist eigentlich nie gemeint.
Vielen Dank für die interessante Frage!
Alles Gute
Hallo! Ich dachte, Maltose sei ein Halbacetal, da eine hydroxygruppe und eine alkoxygruppe an das gleiche kohlenstoffatom gebunden sind und saccharose ein vollacetal?