Moleküldarstellungen von Kohlenhydraten
Hier erfährst du, wie Kohlenhydrate wie Glucose oder Fructose in 2D dargestellt werden. Entdecke die Unterschiede zwischen der Fischer-Projektion und der Haworth-Schreibweise und lerne die Regeln für die räumliche Darstellung von Zuckermolekülen kennen. Interessiert? Das und vieles mehr findest du im folgenden Text!
- Moleküldarstellung von Kohlenhydraten – Fischer-Projektion und Haworth-Schreibweise – Chemie
- Fischer-Projektion und Haworth-Schreibweise – Beispiele und Definition
- Was versteht man unter der Fischer-Projektion? – Beispiel und Regeln
- Haworth-Projektion – Beispiel und Regeln
- Weitere Moleküldarstellungen von Kohlenhydraten
- Fischer-Projektion und Haworth-Schreibweise – Zusammenfassung

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.

Grundlagen zum Thema Moleküldarstellungen von Kohlenhydraten
Moleküldarstellung von Kohlenhydraten – Fischer-Projektion und Haworth-Schreibweise – Chemie
Um eine Vorstellung vom Aufbau verschiedener Zuckermoleküle zu bekommen, sind 3-D-Modelle sicherlich sehr eindrucksvoll und sinnvoll. Vielleicht hast du bereits in der Schule im Chemie- oder Biologieunterricht dreidimensionale Modelle für verschiedene Zuckermoleküle gesehen. Auf den ersten Blick sind sie manchmal jedoch ganz schön verwirrend. Zweidimensionale Darstellungen von Zuckern sind daher sehr hilfreich, um einzelne Zuckermoleküle anschaulich darzustellen.
Dieser Text erklärt dir auf einfache Art und Weise, wie du Kohlenhydrate mit der sogenannten Fischer-Projektion und der Haworth-Schreibweise zweidimensional darstellen kannst. Die Fischer-Projektion und Haworth-Schreibweise werden in der Chemie zum Veranschaulichen oder Darstellen des Aufbaus der Zucker bzw. Kohlenhydrate wie Fructose und Glucose ($\ce{C6H12O6}$) priorisiert.
Um die Fischer-Projektion und Haworth-Schreibweise zu verstehen, solltest du wissen, welche Moleküle zu den Kohlenhydraten gehören. Du solltest dich mit den Zuckern wie Glucose und Fructose vertraut gemacht haben und Grundwissen über ihre Strukturformeln mitbringen.
Fischer-Projektion und Haworth-Schreibweise – Beispiele und Definition
Ein gängiges Beispiel zur Erklärung der Fischer-Projektion und der Haworth-Schreibweise ist Glucose. Kohlenhydrate wie Glucose ($\ce{C6H12O6}$) wechseln in wässriger Lösung zwischen der offenkettigen und ringförmigen Form. Dabei ist die Ringform häufiger als die Kettenform. Die Fischer-Projektion beschreibt die Zuckerstruktur in Kettenform und die Haworth-Schreibweise in Ringform.
Was versteht man unter der Fischer-Projektion? – Beispiel und Regeln
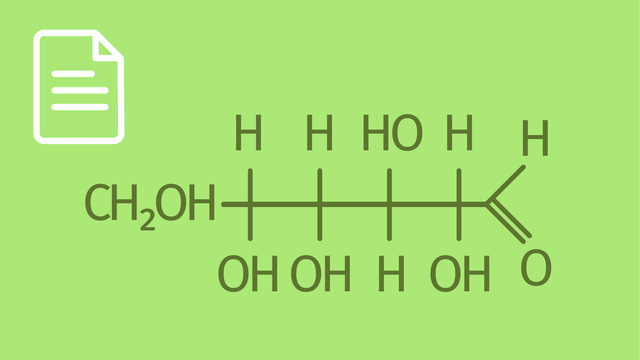
Kannst du dir vorstellen, wie man eine Fischer-Projektion macht? Um zu verstehen, was die Fischer-Projektion aussagt, zeichnet man D-Glucose ($\ce{C6H12O6}$) mit seinen sechs Kohlenstoffatomen als Kette. Damit du dir das besser vorstellen kannst, gehen wir die Nomenklatur der D-Glucose in der Fischer-Projektion einmal genau durch. Am Kohlenstoffatom C-1 sitzt eine Aldehydgruppe ($\ce{-CHO}$) und die anderen fünf C-Atome besitzen jeweils eine Hydroxygruppe ($\ce{-OH}$). Die $\ce{OH}$-Gruppen der Kohlenstoffatome C-2 bis C-5 werden nach der Tatütata-Regel verteilt. Was man unter der Tatütata-Regel bei der Fischer-Projektion versteht, kannst du sehr anschaulich im folgenden Bild sehen.
Zusätzlich besitzt das Glucosemolekül ($\ce{C6H12O6}$) vier Stereozentren an den Kohlenstoffatomen C-2 bis C-5. Dabei ist der Begriff der Chiralität nicht ganz unwichtig, um zu verstehen, was die Fischer-Projektion ist. Ein C-Atom ist chiral oder auch asymmetrisch, wenn es vier verschiedene Substituenten besitzt. Jedes chirale C-Atom kann zwei sogenannte Stereoisomere ausbilden, indem es die räumliche Anordnung der Bindungspartner ändert. Das bedeutet, dass die D-Glucose 16 Stereoisomere besitzt. Wann macht man nun in der Chemie die Unterscheidung in D- und L-Glucose ($\ce{C6H12O6}$)? Die D-Glucose ($\ce{C6H12O6}$) besitzt in der Fischer-Projektion am C-5 eine $\ce{OH}$-Gruppe, die nach rechts zeigt. Bei der L-Glucose ($\ce{C6H12O6}$) zeigt die $\ce{OH}$-Gruppe am C-5 Atom in dieser Schreibweise nach links.
Haworth-Projektion – Beispiel und Regeln
Um die Haworth-Schreibweise, auch Haworth-Projektion genannt, zu verstehen, verwenden wir als Beispiel wieder die D-Glucose ($\ce{C6H12O6}$). Zwischen der Aldehydgruppe ($\ce{-CHO}$) am C-1-Atom und der $\ce{OH}$-Gruppe am C-5-Atom kommt es zu einer intramolekularen Acetalisierung. Diese Ringbildung ist in der Fischer-Projektion wenig anschaulich. Deswegen wird die Fischer-Projektion in die Haworth-Schreibweise umgewandelt. Dazu wendet man die sogenannte FLOH-Regel an. Vielleicht kannst du es schon erraten, was dahintersteckt? Was bei Fischer links ist, ist oben bei Haworth. Umgekehrt gilt natürlich auch: Was bei Fischer rechts ist, ist bei Haworth? Genau unten! Eine genaue Übersicht kannst du dir nochmals in dem folgenden Bild verschaffen.
Zeigt die $\ce{OH}$-Gruppe am C-1-Atom nach unten, handelt es sich um eine $\alpha$-D-Glucopyranose, zeigt sie nach oben, handelt es sich um eine $\beta$-D-Glucopyranose.
Weitere Moleküldarstellungen von Kohlenhydraten
Du hast nun gelernt, wie du die Kettenform (Fischer-Projektion) in die Ringform (Haworth-Schreibweise) überführst. Zucker können neben der Fischer-Projektion und der Haworth-Schreibweise noch in weiteren Formen wie der Keilstrichformel und der Sesselkonformation dargestellt werden. Allerdings sind diese beiden Schreibweisen seltener.
Fischer-Projektion und Haworth-Schreibweise – Zusammenfassung
Für eine anschauliche Darstellung von Zuckern werden die Fischer-Projektion und die Haworth-Schreibweise verwendet. Die Fischer-Projektion beschreibt Kohlenhydrate in Kettenform und die Haworth-Schreibweise stellt Zucker in Ringform dar. Dazu werden bestimmte Regeln wie die Tatütata-Regel oder die FLOH-Regel eingesetzt. Beide Darstellungen stellen die räumliche Struktur der Moleküle zweidimensional dar.
Auch zum Thema Moleküldarstellung von Kohlenhydraten – Fischer-Projektion und Haworth-Schreibweise habe wir einige interaktive Übungen und Arbeitsblätter vorbereitet. Du kannst dein neu gewonnenes Wissen also direkt testen. Viel Spaß!
Transkript Moleküldarstellungen von Kohlenhydraten
Einen schönen guten Tag und herzlich willkommen! Dieses Video heißt: Moleküldarstellungen von Kohlenhydraten. An Vorkenntnissen solltest du schon ein wenig über Kohlenhydrate Bescheid wissen. Glucose und Fructose sollten dir ein Begriff sein. Ziel ist es, dir einen kleinen Überblick über gängige Moleküldarstellungen von Kohlenhydraten am Beispiel der Glucose zu verschaffen. Der Film besteht aus 5 Abschnitten: 1. Problem Glucose 2. Die Fischer-Projektion - trügerische Klarheit 3. Von der Kette zum Ring - die Haworth-Schreibweise 4. Weitere Darstellungsformen 5. Schlussfolgerung 1. Problem Glucose Für Glucose kennen wir die Summenformel C6H12O6. Doch damit wissen wir über das Molekül fast gar nichts. Hilfreich für unsere Betrachtungen ist dabei ein Modell. Seid ihr ob der Darstellungsweise schockiert oder könnt ihr nichts im Modell erkennen, so muss ich euch sagen, dass das beabsichtigt ist. Ein wenig können wir aber erkennen, nämlich das hier: 6 Kohlenstoffatome bilden eine Kette. Wir haben somit eine C6-Einheit vorliegen. Diese funktionelle Gruppe hier ist die CHO-Gruppe, die Aldehydgruppe. Und von diesen funktionellen Gruppen, den OH-Gruppen, haben wir sogar 5. Glucose ist ein Mehrfachalkohol. Ist das alles, was man über die Struktur sagen kann? Leider nein. Das Glucosemolekül verfügt über 4 Chiralitätszentren. Daher spielt die Stereochemie des Moleküls eine große Rolle. Die Moleküldarstellung in der Ebene ist von großer Bedeutung. Aber nun mal Hand aufs Herz: Meint ihr, dass diese 3D-Darstellung des Glucosemoleküls übersichtlich ist? Ich denke, nein. Ein weiterer Grund, die Darstellung aus dem Raum in die Ebene zu verlagern. 2. Die Fischer-Projektion - trügerische Klarheit Bei der Darstellung von Kohlenhydraten in der Ebene bedient man sich gerne der Fischer-Projektion. Dabei geht man so vor: Man zeichnet ein 4-fach-Kreuz wie dieses, das Skelett des Moleküls. Oben ordnet man die Aldehydgruppe an. Die Kreuzungspunkte stellen Kohlenstoffatome dar. An den Kohlenstoffatomen der Kreuzungspunkte sitzen OH-Gruppen in der dargestellten Weise. Man merke sich die Eselsbrücke "ta-tü-ta-ta". Alle 4 Kohlenstoffatome der Kreuzungspunkte sind Chiralitätszentren. Das unterste Kohlenstoffatom wird ausgeschrieben. Es ist kein Chiralitätszentrum. Auch an ihm sitzt eine Hydroxygruppe. Die Darstellung entspricht der Summenformel C6H12O6. Es ist klar, dass aus links rechts folgt. Aber aus rechts folgt durchaus nicht links. Jedes der 4 Chiralitätszentren kann 2 Stereoisomere ausbilden. Das macht zusammen: 2×2×2×2=24, das ergibt immerhin 16 Stereoisomere. Wie kann man mithilfe unseres 3D-Modells zu dieser Fischer-Projektion gelangen? Ich versuche einmal, das Modell etwas zu entzerren. Ich verleihe ihm die natürliche Zickzack-, das heißt Transstruktur. Es ist ein Transkonformer. Ich richte nun das Modell so aus, dass es mit der Fischer-Projektion in Übereinstimmung kommt, und überprüfe die Lage der Hydroxygruppen. Die Hydroxygruppen oben liegen jeweils links. Wir haben also Übereinstimmungen. Bei den 2. Hydroxygruppen sieht es schon schlecht aus, einmal links, einmal rechts. Bei den 3. wieder Übereinstimmungen. Und bei den 4. Hydroxygruppen: einmal rechts und einmal links. Noch einmal prüfen, vielleicht habe ich etwas übersehen. Es hilft alles nichts. Das Zickzack(trans)-Konformer kann es nicht sein, von dem sich die Fischer-Projektion ableitet. Jetzt nehme ich einmal das Modell und falte es praktisch zusammen, dass es in sich geschlossen ist. Das ist eine "unnatürliche" cis-Struktur. Die Lage der Hydroxygruppen lässt sich hier schlecht auslesen. Aber wir werden es einmal versuchen. So, ich denke, jetzt habe ich das Molekül positioniert. Es bildet praktisch einen Buckel. Hier oben, das ist die Aldehydgruppe. Hydroxygruppe rechts - Hydroxygruppe rechts. Hydroxygruppe links - Hydroxygruppe links. Hydroxygruppe rechts - Hydroxygruppe rechts. Hydroxygruppe rechts - Hydroxygruppe rechts. Ein voller Erfolg! Diese chemische Verbindung nennt man D-Glucose. Die L-Glucose ist dazu das Spiegelbildmolekül. Die Fischer-Projektion ist somit sicher übersichtlich und systematisierend, aber stereochemisch dubios. 3. Von der Kette zum Ring - die Haworth-Schreibweise Aus der Kette des Glucosemoleküls soll sich ein Ring bilden. Durch Acetalisierung kommt es zum Ringschluss. Ich zeige einmal, welche Bindungen gebrochen werden und welche neu entstehen. Das Wasserstoffatom, das am Sauerstoffatom saß, das jetzt den Ring bildet, hat sich zum Sauerstoffatom der Aldehydgruppe bewegt. Somit liegt das Glucosemolekül in Ringform vor. Kohlenhydrate in Ringform werden gern in Haworth-Schreibweise dargestellt. Der 6-Ring mit dem Sauerstoffatom ist klar. Man stellt ihn etwas räumlich dar, und die Bindungen zeigen jeweils nach oben und unten. Etwas vereinfacht, aber gut einprägsam. Mithilfe des Modells können wir sehr gut erkennen, wo sich jeweils die Hydroxygruppen befinden, ob oben oder unten. Die verbliebenen Bindungen füllen wir mit Wasserstoffatomen auf, und wir sind fertig. Diese Verbindung heißt α-D-Glucose, weil die blau gekennzeichnete Hydroxygruppe nach unten zeigt. Wir versuchen nun zu zeigen, wie man aus der Fischer-Projektion die Haworth-Schreibweise in etwa ableitet. Das ist die Fischer-Schreibweise der D-Glucose, erinnert euch. Und Links haben wir die Haworth-Schreibweise für die Ringstruktur. Auch hier gibt es eine Eselsbrücke, sie heißt FLOH. Das bedeutet: Fischer Links, Oben Haworth. Wir nummerieren einmal die Kohlenstoffatome des offenkettigen Glucosemoleküls. Beim 2. Kohlenstoffatom zeigt die Hydroxygruppe in der Fischer-Projektion nach rechts, in der Haworth-Formel nach unten. Beim 3. Kohlenstoffatom zeigt OH in der Fischer-Projektion nach links, in der Haworth-Formel nach oben. Und am 4. Kohlenstoffatom zeigt in der Fischer-Projektion OH nach rechts. In der Haworth-Schreibweise sehen wir die Hydroxygruppe nach unten ausgerichtet. Tja, gar nicht so einfach. Also besser und klarer ist es natürlich, die Haworth-Schreibweise aus der 3D-Struktur des Modells abzulesen. 4. Andere Darstellungsformen Eine Möglichkeit ist noch die Darstellung des 6-Rings als Sessel. Die entsprechenden Substituenten sind dann so angeordnet, wie ich es hier darstelle. Die Wasserstoffatome, die vom 6-Ring abzweigen, werden häufig nicht eingezeichnet. Und auch diese sterische Darstellungsweise dürfte euch bekannt sein. Ein geschlossener Keil zeigt aus der Ebene heraus, ein gestrichelter Keil ragt in die Ebene hinein. Hierbei handelt es sich um die stereochemische Ansicht. 5. Schlussfolgerung Man muss betonen, dass die Schreibweisen nach Fischer und Haworth relativ häufig verwendet werden; Fischer vorzugsweise für die Kette und Haworth für den Ring. Die Fischer-Projektion ist antiquiert, stereochemisch dubios, aber systematisierend. Die Haworth-Schreibweise ist trotz gewisser Vereinfachung recht anschaulich. Und nun die wichtigste Schlussfolgerung aus dem Video: Ohne 3D-Modelle ist das Arbeiten mit Moleküldarstellungen wenig sinnvoll. Ich hoffe, ihr hattet etwas Spaß und habt einige interessante Dinge erfahren. Ich wünsche euch alles Gute und viel Erfolg. Tschüss!
Moleküldarstellungen von Kohlenhydraten Übung
-
Benenne die einzelnen Darstellungsformen für Kohlenhydrate.
TippsWas waren die Merkmale der Fischer-Projektion?
LösungEs gibt viele unterschiedliche Varianten, ein Molekül darzustellen. Hier die groben Merkmale einiger Darstellungsformen:
Kugel-Stab-Modell:
- Atome werden durch Kugeln dargestellt, wobei jede Kugelfarbe für ein bestimmtes Atom steht
- Atombindungen werden durch Stäbe dargestellt
- dreidimensionales Modell
- die Kohlenstoffkette wird von oben nach unten aufgeschrieben
- das am stärksten oxidierte Kohlenstoffatom steht oben
- die Verbindungen zwischen den Atomen werden durch gerade Striche gekennzeichnet
- Moleküle werden in der planaren Ringform dargestellt
- bei Fünfringen liegt der Sauerstoff in der Ecke, die vom Betrachter am weitesten entfernt ist, bei Sechsringen befindet sich der Sauerstoff in der hintersten rechten Ecke
- Atome und Atomgruppen, die nicht direkt im Ring eingebunden sind, werden an waagerechte Striche geschrieben
- räumliche Struktur wird dadurch dargestellt, dass die Atombindungen als Keile, Striche und gestrichelte Keile gezeichnet werden
- Striche bedeuten, dass die Verbindung auf der Zeichenebene liegen
- Mehrfachbindungen liegen immer auf der Zeichenebene, das macht die Darstellung leichter
- voll ausgemalte Keile deuten an, dass sich ein Atom oder eine Gruppe vor der Zeichenebene befindet
- gestrichelte Keile deuten an, dass sich ein Atom oder eine Gruppe hinter der Zeichenebene befindet
-
Erkläre, warum so viele unterschiedliche Darstellungsformen notwendig sind.
TippsWarum kann man nicht alles mit einem Modell erklären und darstellen?
LösungJede Darstellungsform hat ihre Vor- und Nachteile. Deshalb eignen sich die einzelnen Darstellungsformen auch für unterschiedliche Erklärungen.
Beispiele: Die Fischer-Projektion
Vorteile:
- sehr übersichtlich
- schematisch
- berücksichtigt nicht die Dreidimensionalität von Molekülen
- stellt nur die offene Kettenform von Kohlenhydraten dar
- ist nur bei einfachen (monomeren) Kohlenhydraten übersichtlich
- Darstellung von Monosachariden (einfachen Kohlenhydraten)
- Darstellungen verschiedener Isomerien
Vorteil:
- berücksichtigt die räumliche Struktur
- ist nicht übersichtlich
- lässt sich nur schwer zweidimensional abbilden
- Darstellung der Dreidimensionalität eines Moleküls
- Darstellung von Atombindungen
- Darstellungen von Raumstrukturen der Moleküle
-
Entscheide, welche Moleküle Streoisomere von D-Glucose sind.
TippsStereoisomere unterscheiden sich in der räumlichen Anordnung, haben aber dieselbe Struktur.
LösungAus der Summenformel $C_6H_{12}O_6$ können viele Isomere entstehen. Stereoisomere haben dieselbe Strukturformel und dieselbe Konstitution (Anordnung der Atome und Atomgruppen), unterscheiden sich aber in der räumlichen Anordnung. Die erste Auswahl ist allerdings identisch mit D-Glucose.
Beispiel: L-Mannose und D-Galactose besitzen am ersten Kohlenstoffatom die Aldehydgruppe. Sie besitzen beide 6 Kohlenstoffatome, die kettenförmig miteinander verbunden sind. Sie unterscheiden sich nur in der Position der Hydroxygruppen und des Wasserstoffatoms am dritten, vierten und fünften Kohlenstoffatom.
Fructose ist zwar auch ein Isomer von $C_6H_{12}O_6$, aber aufgrund der Ketogruppe am zweiten Kohlenstoffatom kein Stereoisomer von Galactose und Mannose. Es hat durch die Ketogruppe eine andere Konstitution.
-
Erstelle die Haworth-Schreibweise aus der gegebenen Fischer-Projektion.
TippsBeachte die FLOH-Regel.
Wenn bei der Fischerprojektion eine OH-Gruppe auf der linken Seite steht, wo muss sie dann bei der Harworth-Darstellung stehen?
LösungRingschluss bei Kohlenhydraten
Bei Kohlenhydraten mit 6 Kohlenstoffatomen kann der Ringschluss zwischen dem 1. und 4. oder zwischen dem 1. und 5. Kohlenstoffatom stattfinden. In unserem Beispiel findet der Ringschluss zwischen dem 1. und 5. Kohlenstoffatom statt.
Das $\beta$ vor dem Namen der Haworth-Schreibweise bedeutet, dass die OH-Gruppe am 1. Kohlenstoffatom oben steht.
Um ein Molekül von der Fischer-Projektion in die Haworth-Schreibweise umzuwandeln und wieder zurück, kannst du die FLOH-Hilfe verwenden.
Fischer links, oben Haworth
Das bedeutet, alles was bei der Fischerprojektion auf der linken Seite steht, steht in der Haworth-Projektion oben.
-
Benenne die Stereozentren im Glucosemolekül.
TippsStereozentren haben immer vier unterschiedliche Substituenten.
LösungChiralität
Bei der Glucose sind die Kohlenstoffatome 2, 3, 4 und 5 chiral. Ein Kohlenstoffatom ist dann chiral, wenn es vier unterschiedliche Substituenten (Atome oder Atomgruppen) besitzt.
In der Abbildung ist z.B. das 4. Kohlenstoffatom chiral, da es 4 unterschiedliche Substituenten besitzt. Links eine Hydroxygruppe (gelb), rechts ein Wasserstoffatom (pink), oben der Rest mit der Ketogruppe (blau) und untern der andere Rest des Moleküls (grün).
Ist ein Kohlenstoffatom in einem Molekül chiral, so wird es als Stereozentrum bezeichnet. Für jedes Stereozentrum können zwei Stereoisomere entstehen. Moleküle, die sich mit ihrem Spiegelbild nicht in Deckung bringen lassen werden als chiral bezeichnet.
Chirale Moleküle sind in der Lage, polarisiertes Licht zu drehen. Auch ist die Wirkung von organischen Stereomeren im Körper unterschiedlich.
-
Entscheide, welche Moleküldarstellungen das gleiche Molekül zeigen.
TippsWas bedeutete noch einmal FLOH?
LösungUmwandlung von der Haworth-Projektion in die Sesselkonfiguration
Bei der Umwandlung der Haworth-Projektion in die Sesselkonfiguration wird eine Ecke des Sechsrings nach oben geklappt und die andere nach unten.
Nun müssen die Positionen der Substituenten verändert werden. In der Abbildung ist die linke Ecke nach oben geklappt.
1.$~$Regeln für die nach oben geklappte Ecke:
- Alle Substituenten, die in der Haworth-Projektion unten standen, erhalten nun eine äquatoriale Position.
- Bsp.: blau markierte OH-Gruppe
- Die Substituenten, die vorher oben standen, erhalten eine axiale Position.
- Bsp.: grün markierte OH-Gruppe
- Alle Substituenten, die in der Haworth-Projektion unten standen, erhalten nun eine axiale Position.
- Bsp.: gelb und rot markierten OH-Gruppen.
- Die Substituenten, die vorher oben standen, erhalten eine äquatoriale Position.

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
9'178
sofaheld-Level
6'600
vorgefertigte
Vokabeln
7'642
Lernvideos
35'607
Übungen
32'360
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation


 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?















Bitte bei "Chemie für Mediziner" suchen.
Alles Gute
A. O.
Welches Video würde mir denn die Fischer Projektion vom Anfang erklären und inhaltlich das ta tü ta ta Prinzip, im Bezug auf asymmetrische Kohlenstoffe, veranschaulichen?