Monosaccharide – Nomenklatur und Stereochemie

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Monosaccharide – Nomenklatur und Stereochemie
In diesem Video geht es um die Nomenklatur und die Stereochemie der Monosaccharide. Dazu wird zuerst ein allgemeiner Überblick über das Thema gegeben und dann erklärt, ob der systematische Name oder der Trivialname günstiger im Umgang mit Monosacchariden ist. Im Anschluss wird dann auf wichtige Vertreter der Monosaccharide eingegangen und die Nomenklatur und die Stereochemie geklärt.
Transkript Monosaccharide – Nomenklatur und Stereochemie
Guten Tag und herzlich willkommen! In diesem Video geht es um Monosaccharide, ihre Nomenklatur und Stereochemie. Für das Verständnis dieses Videos sind folgende Vorkenntnisse von Nutzen: Kohlenhydrate, Monosaccharide, Aldosen, Ketosen, Triosen, Tetrosen, Pentosen, Hexosen und ihr solltet euch schon in den Grundlagen der Stereochemie auskennen. Ziel des Videos ist es, euch erste Vorstellungen über Nomenklatur und Stereochemie als Einheit für die Benennung von Monosacchariden zu vermitteln.
Den Film habe ich in 8 Abschnitte gegliedert: 1. Warum beides zusammengehört. 2. Trivialnamen oder systematische Namen? 3. Triosen. 4. Threose und Erythrose. 5. Ribose und andere Pentosen. 6. Viele Hexosen. 7. Epimere. Und 8. Zusammenfassung.
Warum beides zusammengehört: Betrachten wir einmal die Strukturformel eines einfachen Monosaccharids. Sicher werdet ihr es schon als Glycerinaldehyd erkannt haben. Die Strukturformel ist aber auch so darstellbar, mit mittlerer Hydroxygruppe auf der anderen Seite. Gehören beide Darstellungen zu ein und derselben chemischen Verbindung? Natürlich nicht, das mittlere Kohlenstoffatom ist chiral. Wir haben es hier mit Enantiomeren zu tun. Die Formeln links und rechts beschreiben unterschiedliche chemische Verbindungen. Bei der linken Verbindung handelt es sich um D-Glycerinaldehyd, bei der rechten Verbindung um L-Glycerinaldehyd. Die linke Verbindung dreht polarisiertes Licht nach rechts, während die rechte Verbindung dies nach links tut. Es ist offensichtlich, Nomenklatur und Stereochemie bilden in der Beschreibung eines Moleküls eine Einheit.
Trivialnamen oder systematische Namen? Wir wollen einmal an einigen Monosaccharidmolekülen untersuchen, welche der Namen, Trivialnamen oder systematische Namen, für uns praktischer zu verwenden sind. Betrachten wir wieder das D-Glycerinaldehyd. Das ist übrigens der Trivialname. Mit systematischen Namen heißt die Verbindung (R)-2,3-Dihydroxypropanal. Welcher der beiden Namen ist bequemer zu handhaben? Ich glaube, ihr stimmt mir zu - der obere. Es steht 1:0 für die Trivialnamen. Schauen wir uns einmal dieses Molekül an. Der Trivialname lautet D-Threose. Der systematische Name lautet (2R,3R)-2,3,4-Trihydroxybutanal. Nun, welcher Name ist bequemer zu handhaben? Na klar, der Trivialname. Es steht somit 2:0 für die Trivialnamen. Und nun ein noch größeres Molekül - es ist ein Beispiel für ein Hexose. Kennt ihr dieses Molekül? Um welche Verbindung handelt es sich? Richtig, es ist D-Glukose. D-Glukose ist der Trivialname für dieses Monosaccharid. Der systematische Name lautet (2R,3S,4R,5R)-2,3,4,5-Pentahydroxyhexanal. Welche der beiden Namen ist einfacher zu handhaben? Na klar - der obere. Es steht somit 3:0 für die Trivialnamen. Offensichtlich ist es so, dass Handhabbarkeit einer Strukturformel und ihrer Exaktheit gegenläufige Eigenschaften sind. Dann kann man feststellen, dass die Exaktheit bei den systematischen Namen natürlich am größten ist, denn sie sollen ja das Molekül exakt darstellen. Das Schöne bei Trivialnamen ist, dass sie gut handhabbar sind. Wir können somit feststellen, Trivialnamen sind den systematischen Namen klar vorzuziehen.
Kommen wir nun 3. zu den einfachsten Monosacchariden, den Triosen: Davon gibt es logischerweise nicht viele. Es gibt 2 Aldosen. Wir haben sie bereits im Video besprochen, nämlich D-Glycerinaldehyd und L-Glycerinaldehyd. Beide sind zueinander enantiomer. Es sind zwei Stereoisomere. Darüber hinaus gibt es noch eine Ketose. Diese hat kein chirales Zentrum und heißt Dihydroxyaceton. Dihydroxyaceton ist eine Keto-triose. Bei den enantiomeren Glycerinaldehydmolekülen handelt es sich um Aldo-triosen.
Threose und Erythrose: An den Vorgaben der Fischer-Projektion könnt ihr schon erkennen, dass es sich hier um Tetrosen handelt. Oben befindet sich jeweils eine Aldehydgruppe. Es handelt sich somit um Aldosen. Die Verbindungen unterscheiden sich voneinander in ihrer Konfiguration. Es sind somit Stereoisomere. Die Verbindungen heißen, von links nach rechts: D-Threose, L-Threose, D-Erythrose und L-Erythrose. Die Namen Threose und Erythrose sind selbstredend Trivialnamen. D bedeutet, dass sich die Hydroxygruppe am vorletzten Kohlenstoffatom rechts befindet, während bei L die Hydroxygruppe links sitzt. Bei den beiden Verbindungen auf der linken Seite handelt es sich um ein Paar von Enantiomeren. Gleichwohl sind die beiden Verbindungen auf der rechten Seite enantiomer zueinander. Alle anderen Paare von Verbindungen bilden zusammen Diastereomerenpaare. Ich bezeichne die Verbindungen von links nach rechts mit den Symbolen von 1 - 4. Dann sind folgende Paare von Verbindungen Diastereomere: (1,3), (1,4), (2,3) und (2,4).
Ribose und andere Pentosen: Für Pentosen sehen die Gerüste der Fischer-Projektion so aus: Das 1. Monosaccharid ist regelmäßig gebaut. Die Hydroxygruppen an den chiralen Zentren befinden sich jeweils auf der rechten Seite. Bei dem Monosaccharid handelt es sich um D-Ribose. Betrachten wir dieses Molekül: Im Unterschied zum Molekül der D-Ribose besitzt es am 2. Kohlenstoffatom 2 Wasserstoffatome. Es wurde reduziert. Es hat 1 Sauerstoffatom in Stellung 2 verloren. Deshalb nennt man diese Verbindung 2-Desoxy-D-Ribose. Und noch eine wichtige Pentose, das ist die D-Ribulose. D-Ribose und 2-Desoxy-D-Ribose sind Aldosen. Bei der D-Ribulose handelt es sich um eine Ketose. Die Bezeichnung D bedeutet, dass sich beim vorletzten Kohlenstoffatom die Hydroxygruppe jeweils auf der rechten Seite des Moleküls befindet.
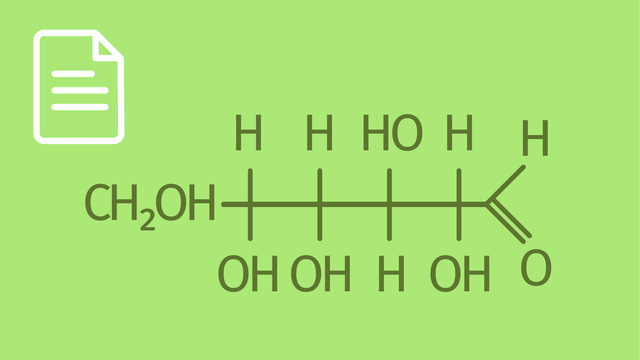
Viele Hexosen: So sehen die Grundskelette in Fischer-Projektion für Hexosen aus. Nehmen wir dieses Beispiel: Wie wir sehen, besitzt das Molekül 4 chirale Zentren. Das bedeutet, dass wir mit 24 Isomeren zu rechnen haben, das sind 16 Stereoisomere. Bei der Verbindung handelt es sich um D-Glukose. Das D bedeutet wieder, dass am vorletzten Kohlenstoffatom die Hydroxygruppe sich in der Fischer-Projektion rechts befindet. Ein Konfigurationsisomer der D-Glukose ist D-Mannose. Und das ist ein weiteres Konfigurationsisomer zu D-Glukose und D-Mannose - die D-Galactose. Neben diesen 3 Aldohexosen ist diese Aldoketose von Bedeutung. Es handelt sich um D-Fructose. Das Molekül verfügt über 3 chirale Zentren. Damit existieren 23=8 Konfigurationsisomere.
Epimere: Epimere sind Monosaccharide, die sich nur an einem einzigen chiralen Zentrum voneinander unterscheiden. Sind 1 und 2 Epimere? 1 und 2 sind Epimere. Sie unterscheiden sich am chiralen Zentrum (2). Sind 1 und 3 Epimere? 1 und 3 sind Epimere. Sie unterscheiden sich am chiralen Zentrum (4). Sind 2 und 3 Epimere? 2 und 3 unterscheiden sich am chiralen Zentrum (2), aber darüber hinaus auch am chiralen Zentrum (4). Daher sind 2 und 3 keine Epimere.
Zusammenfassung: D-Glukose und D-Mannose sind Epimere. Sie unterscheiden sich am chiralen Zentrum (2). D bedeutet, dass sich in der Fischer-Projektion am vorletzten Kohlenstoffatom hier, am 5. Kohlenstoffatom, die Hydroxygruppe auf der rechten Seite befindet. Für Monosaccharide wird vorzugsweise die D/L-Nomenklatur verwendet. Beim Vorhandensein von n chiralen Zentren erhält man 2n Stereoisomere. Wir haben gezeigt, dass die Trivialnamen in der Handhabung einfacher sind als die systematischen Namen. Daher sind die Trivialnamen den systematischen Namen im Umgang vorzuziehen. Wir haben die Formeln einiger wichtiger Monosaccharide besprochen: D-Galactose, D-Fructose, D-Ribose, 2-Desoxy-D-Ribose, D-Ribulose, D-Threose, L-Threose, D-Erythrose, L-Erythrose, Glycerinaldehyd und Dihydroxyaceton.
Ich danke für die Aufmerksamkeit, alles Gute - auf Wiedersehen!
Monosaccharide – Nomenklatur und Stereochemie Übung
-
Vervollständige die Strukturformel von D- und L-Glycerinaldehyd.
TippsDas D steht für dextrum (lat.) = rechts.
LösungAldotriosen verfügen über nur ein chirales Kohlenstoffatom, daher gibt es nur zwei von ihnen. Diese unterscheiden sich in der Position der Hydroxylgruppe am mittleren Kohlenstoffatom. Da dieses vier unterschiedliche Gruppen trägt, ist es chiral und die beiden Aldotriosen sind nicht deckungsgleich. Sie verhalten sich wie Bild und Spiegelbild. Es handelt sich daher um zwei chemisch unterscheidbare Verbindungen, die sich jedoch sehr ähnlich sind.
Zur Darstellung der Monosaccharide wird häufig die hier dargestellte Fischer-Projektion verwendet. Hier werden die Unterschiede der beiden Enantiomere auf einen Blick deutlich. Die Substituenten zeigen bei dieser Projektion aus der Papierebene hinaus.
Die D- und L-Nomenklatur der Monosaccharide bezieht sich auf die Position der Hydroxygruppe am chiralen C-Atom, das am weitesten von der Keto-Gruppe entfernt liegt. Zeigt diese Gruppe in der Fischer-Projektion nach rechts, handelt es sich um die D-Form des Zuckers, zeigt sie nach links, handelt es sich um die L-Form.
-
Benenne die Monosaccharide.
TippsDie D- und L-Notation bezieht sich auf das chirale Kohlenstoffatom, das am weitesten von der Aldehyd- oder Ketogruppe entfernt liegt.
Ribose ist eine Pentose.
LösungMonosaccaride sind die kleinsten Bausteine der Kohlenhydrate. Doch auch diese Moleküle sind bereits so groß, dass die systematischen Namen unhandlich zu gebrauchen sind. Da die Verbindungen so wichtig sind und häufig vorkommen, werden in der Regel die Trivialnamen der Monosaccharide verwendet. Diese lassen jedoch leider keinerlei Rückschlüsse auf die Struktur der Verbindungen zu.
Beschäftigt man sich mit der Chemie der Zucker, ist es daher unerlässlich, sich einige Trivialnamen der wichtigsten Monosaccharide zu merken. Die wichtigsten und häufigsten Monosaccharide hast du im Video kennengelernt. Zu jedem Namen gibt es je zwei Formen - die D- und die L-Form. Diese Bezeichnung zeigt die Konfiguration des letzten anomeren Kohlenstoffatoms an. -
Benenne die folgenden Verbindungen mit systematischem Namen.
TippsÜberlege dir, wie viele C-Atome die unterschiedlichen Monosaccharide haben.
Das letzte chirale C-Atom entscheidet über D- bzw. L-Form. Dabei ist D = R und L = S.
LösungDie richtigen Strukturformeln zu den Trivialnamen zu kennen, ist ein bisschen wie Vokabellernen für Chemiker. Das erste, was du wissen musst, ist die Anzahl der C-Atome in den Monosacchariden. Diese findest du leicht in den systematischen Namen wieder. Der letzte Teil des Namens gibt die Länge der Kohlenwasserstoff-Kette an: Propanal hat drei C-Atome, Butanal vier, Pentanal fünf und Hexanal hat sechs C-Atome. Die beiden einzigen Hexosen, die in der Aufgabe aufgeführt sind, sind L- und D-Glucose. Diese müssen je einem Hexanal zugeordnet werden.
Am letzten chiralen C-Atom erkennst du, ob es sich um die L- oder D-Form handelt. Dies findest du im systematischen Namen im ersten Namensteil - hier ist für jedes chirale C-Atom die Drehrichtung angegeben, mit R für rechts und S für links. Der systematische Name mit der Kennzeichnung 5S ist also die L-Glucose, die Verbindung mit 5R die D-Glucose.
Die Zuordnung von D-Glycerinaldehyd zu (R)-2,3-Dihydroxypropanal ist eindeutig, es steht nur ein Propanal zur Auswahl und auch die Kennzeichnung R stimmt.
R-Erythrose und R-Threose sind beides Butanale und haben beide die Kennzeichnung 3R. Daher schauen wir uns die Konfiguration am zweiten Kohlenstoffatom an: (2R,3R) ist die Kennzeichnung für D-Erythrose, (2S,3R) die Kennzeichnung für D-Threose.
-
Entscheide, ob es sich um Epimere handelt.
TippsEpimere unterscheiden sich in der Konfiguration genau eines Chiralitätszentrums.
LösungEpimere sind Stereoisemere mit mehreren Chiralitätszentren, die sich in der Konfiguration von nur einem Chiralitätszentrum unterschieden. Diese Klassifizierung lässt sich auf alle Monosaccharide mit mehr als drei Kohlenstoffatomen anwenden.
Die D-Idose ist eine Hexose mit der Konfiguration (2S,3R,4S,5R), es gibt also genau vier Epimere dieser Verbindung.
Da sich Paare von Enantiomeren in allen Chiralitätszentren unterscheiden, können diese keine Epimere sein. Die L-Idose ist daher kein Epimer der D-Idose.Die D-Mannose utnerscheidet sich von der D-Idose in der Konfiguration des dritten und vierten Kohlenstoffatoms. Die beiden Monosaccharide sind daher ebenfalls keine Epimere.
Die Übrigen gezeigten Verbindungen sind Epimere der D-Idose. Die L-Glucos unterscheidet sich in der Konfiguration des fünften Kohlenstoffatoms, die D-Altrose in der des vierten und die D-Gulose in der des zweiten Kohlenstoffatoms. //
-
Ergänze die Enantiomerenpaare.
TippsEnantiomere verhalten sich exakt wie Bild und Spiegelbild.
Deine linke und deine rechte Hand sind Enantiomere.
LösungMonosaccharide mit vier oder mehr Kohlenstoffatomen haben mindestens zwei chirale Zentren. Daher gibt es unterschiedliche Arten von Stereoisomeren. Verhalten sich diese Isomere wie Bild und Spiegelbild, werden sie als Enantiomere bezeichnet. Stereoisomere, auf die dies nicht zutrifft, werden als Diastereomere bezeichnet.
Die zwei Enantiomere werden jeweils als D- bzw. L-Form des Monosaccharids bezeichnet. Bei den Tetrosen, die hier dargestellt sind, ist dies einfach zu merken: Sind beide Hydroxy-Gruppen auf der gleichen Seite bei der Fischer-Projektion, handelt es sich um Erythrose. Sind sie einander gegenüber, handelt es sich um Threose. -
Charakterisiere die Monosaccharide stereochemisch.
TippsEpimere sind Stereoisomere mit mehreren Chiralitätszentren, die sich in der Konfiguration von nur einem Chiralitätszentrum unterscheiden.
Sind zwei Verbindungen Epimere zueinander, sind sie auch gleichzeitig Diastereomere.
Enantioneme verhalten sich wie Bild und Spiegelbild.
LösungBei allen dargestellten Verbindungen handelt es sich um Aldohexosen. Es lässt sich also mindestens einer der Begriffe Enantiomer, Diastereomer oder Epimer zu je einem Paar an Verbindungen zuordnen. Bei allen Verbindungen handelt es sich also um Stereoisomere.
Enantiomere verhalten sich wie Bild und Spiegelbild. Bei mehreren Chrialitätszentren heißt das, dass sich die Konfiguration in jedem Chiralitätszentrum unterscheidet. Stereoisomere, die keine Enantiomere sind, werden als Diastereomere bezeichnet. Es gibt also keine Verbindungen, die gleichzeitig Diastereomere und Enantiomere sind. Die Verbindungen 2 und 3 sowie 4 und 5 sind Enantiomere.Bei Epimeren handelt es sich um Stereoisormere mit mehreren Chrialitätszentren, die sich in der Konfiguration von genau einem Chiralitätszentrum unterscheiden. Enantiomere können also keine Epimere sein. Bei Epimeren handelt es sich aber immer um Diastereomere. Unter den gezeigten Verbindungen gibt es drei Paare von Epimeren, die auch immer Diastereomere sind: Die Verbindungen 1 und 2, 3 und 4, sowie 1 und 5.
Bei Verbindungen, die sich in der Konfiguration von zwei oder drei der vier Chiralitätszentren unterscheiden, handelt es sich um Diastereomere, die jedoch keine Epimere oder Enantiomere sind sind. Dies ist bei den übrigen Paaren an Verbindungen der Fall.
Insgesamt sind also zwei Paare von Enantiomeren, drei Paare von Epimeren und acht Paare von Diastereomeren gezeigt. Dies gibt auch die Häufigkeiten dieser Paare wieder: Jede Aldohexose hat nur ein Enantiomer. Da es 16 Aldohexosen gibt, hat jede Aldohexose 15 Diastereomere. Bei vier dieser Diastereomeren handelt es sich um Epimere, da Aldohexosen über vier Chiralitätszentren verfügen.

Grundbaustoffe der Nahrung – Kohlenhydrate, Eiweiße und Fette

Monosaccharide

Glucose und Fructose

Glucose – Kette oder Ring?

Monosaccharide mit 3 bis 6 C-Atomen

Monosaccharide – Nomenklatur und Stereochemie

Monosaccharide – Eigenschaften und Reaktionen

Pyranosen und Furanosen

D-Ribopyranose und D-Ribofuranose

Sesselform-Schreibweise der Pyranosen

Halbacetal- und Acetalbildung

Disaccharide

Disaccharide – Besondere Glykoside

Reduzierende und nichtreduzierende Disaccharide

Saccharose und Maltose

Polysaccharide

Polysaccharide – Cellulose, Stärke, Glykogen

Stärke und Cellulose

Nachweis von Kohlenhydraten

Moleküldarstellungen von Kohlenhydraten

Zuckerderivate
Glykoside und glykosidische Bindung

Glykolipide und Glykoproteine

Hyaluronsäure, Heparin, Chitin
9'178
sofaheld-Level
6'600
vorgefertigte
Vokabeln
7'642
Lernvideos
35'607
Übungen
32'360
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation




 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?









Hallo Janas,
der große Unterschied zwischen L-Erythrose und L-Threose ist, dass sich in der Fischer-Projektion bei der L-Erythrose beide OH-Gruppen auf der linken Seite befinden. Und bei der L-Threose nur die untere OH-Gruppe sich links befindet.
Liebe Grüße aus der Redaktion
Das zweite Molekül müsste doch L-Erythrose sein, da die obere OH-Gruppe rechts ist. Und nur bei Threose ist die erste OH-Gruppe links?! Erythrose gibt es aber nicht zur Auswahl...
Hallo,
Warum darf ich bei Kohlenhydraten einzelne Substituenten nicht frei drehen, sodass es dann Konformationsisomere wären? Denn bei Einfachbindungen ist ja normalerweise eine freie Drehbarkeit erlaubt. Habe jetzt schon eine Weile im Internet nach der Ursache gesucht, bin aber lediglich auf die Peptidbindung sowie auf die sterische Hinderung gestoßen.
Ich bedanke mich recht herzlich im Voraus.