Reaktionsmechanismen der Kohlenwasserstoffe
Nucleophile, Elektrophile Substitution, Addition, Eliminierung, Aldol-Kondensation, I und M Effekte, radikalische Addition, radikalische Substitution
Beliebteste Videos
Jetzt mit Spass die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
- Reaktionstypen im Überblick
- Nucleophile und elektrophile Substitution
- Nucleophile und elektrophile Addition
- Eliminierungsreaktion
Reaktionstypen im Überblick
Kohlenwasserstoffe sind Verbindungen der organischen Chemie. Wie ihr Name schon sagt, bestehen sie aus Kohlenstoff und Wasserstoff. Kohlenstoffwasserstoffverbindungen treten in Form von Ketten und Ringen auf.
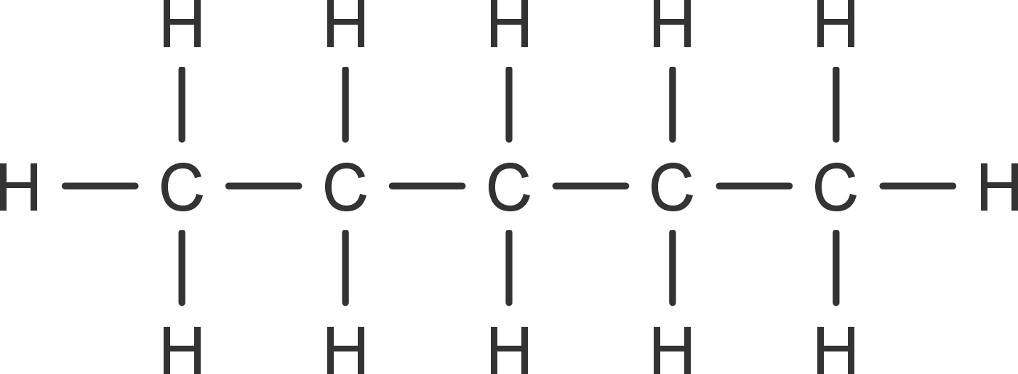
Mithilfe des Kohlenstoffgerüsts können so unzählige organische Verbindungen entstehen. Wichtig zu kennen sind hierbei vor allem die Alkane, Alkene und Alkine. Sie bilden die Grundlage der organischen Verbindungen.
Es gibt verschiedene Reaktionstypen der Kohlenwasserstoffe. Bei der Oxidation reagieren Kohlenwasserstoffe bei ausreichender Sauerstoffzufuhr zu Kohlenstoffdioxid und Wasser. Eine weitere Reaktionsart der Kohlenwasserstoffe ist die Substitution. Auch Additionsreaktionen gehen diese Verbindungen ein. Eliminierungsreaktionen kommen ebenfalls bei Kohlenwasserstoffen vor.
Nucleophile und elektrophile Substitution
Eine Substitutionsreaktion ist eine Reaktion bei der Atome oder Atomgruppen gegen andere ausgetauscht werden. Es gibt die Art der nucleophilen Substitution. Dabei greift eine Verbindung nuclephil die Kohlenwasserstoffverbindung an. Nucleophil bedeutet kernliebend. Ein Nucleophil wird also von positiven Ladungen oder Teilladungen angezogen.
Ein klassisches Beispiel ist die Reaktion eines aliphatischen Kohlenwasserstoffs mit einem Halogen, wie Chlor. Es entsteht ein Halogenkohlenwasserstoff und ein Halogenwasserstoff, wie Chlorwasserstoff. Diese Reaktion kann auf zwei verschiedene Weisen ablaufen. Die Reaktionsmechanismen sind SN1 und SN2.
SN1 ist eine Reaktion erster Ordnung, d.h. nur eine Komponente ist geschwindigkeitsbestimmend. Bei diesem Mechanismus entsteht als Zwischenprodukt ein Carbokation.
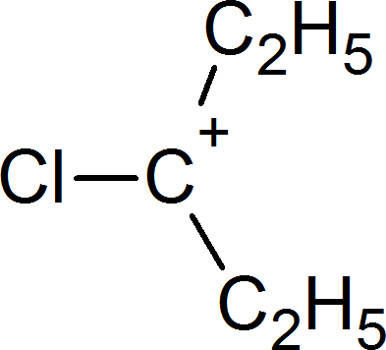
Bei dem Mechanismus SN2 entsteht dieses nicht. Hier sindzwei Komponenten geschwindigkeitsbestimmend.
Eine weitere Art ist die elektrophile Substitution. Diese läuft bei Aromaten ab. Aufgrund der Doppelbindungen im Benzolring können Elektrophile (negative Ladungen liebend) am Aromaten angreifen und so Wasserstoffatome gegen andere Atome oder Atomgruppen austauschen. Bei diesem Reaktionsmechanismus bildet sich zuerst ein $\Pi$-Komplex und dann ein $\sigma$-Komplex. Anschließend bildet sich die kovalente Bindung zum neuen Substituenten aus.
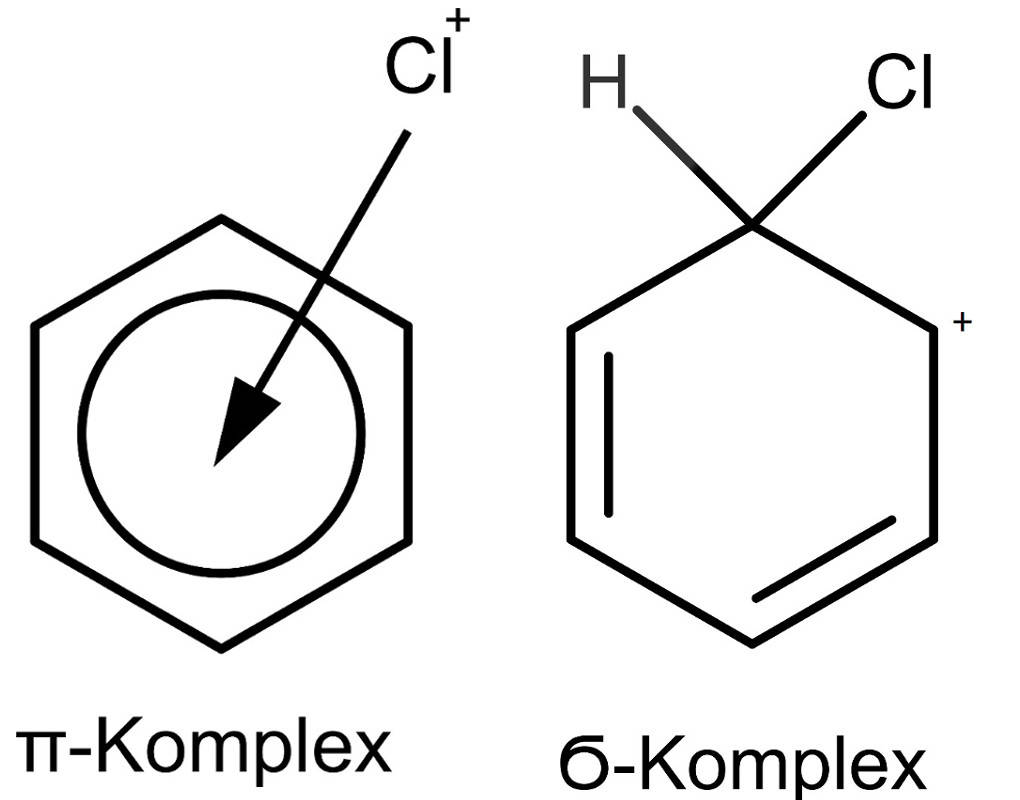
Nucleophile und elektrophile Addition
Bei der Additionsreaktion reagieren mehrere Edukte zu einem einzigen Produkt. Auch hier gibt es zwei verschiedene Arten, die nucleophile und die elektrophile.
Die nucleophile Addition tritt bei Kohlenwasserstoffen auf, wenn polarisierte Gruppen vorliegen. Häufig ist hier die Carbonyl-Gruppe $(C=O)$ anzutreffen. Sie ist in mehreren funktionellen Gruppen enthalten. Der Aldehyd-Gruppe $(-CHO)$, der Carboxyl-Gruppe $(-COOH)$ und der Keto-Gruppe $(-CO-)$. Das elektronegativere Sauerstoffatom zieht die Bindungselektronen stark an sich. Dadurch wird das Kohlenstoffatom positiviert und damit empfänglich für nucleophile Angriffe.
Solche Nucleophile sind beispielsweise Hydroxide, Cyanide, Alkohole und Amine. Es kommt zur Aufspaltung der Doppelbindung zwischen Kohlenstoff- und Sauerstoffatom und ein neues Molekül entsteht, ein Addukt.
Bei der elektrophilen Addition kommt es zum Angriff einer Doppelbindung zwischen zwei Kohlenstoffatomen. Hier herrscht eine hohe Elektronendichte und Elektrophile können somit gut angreifen. So kann ein Chlormolekül mit einem Alken eine elektrophile Addition eingehen. Dabei wird die Doppelbindung aufgespalten und die beiden Chloratome besetzen die freie Bindung an jeweils einem Kohlenstoffatom.
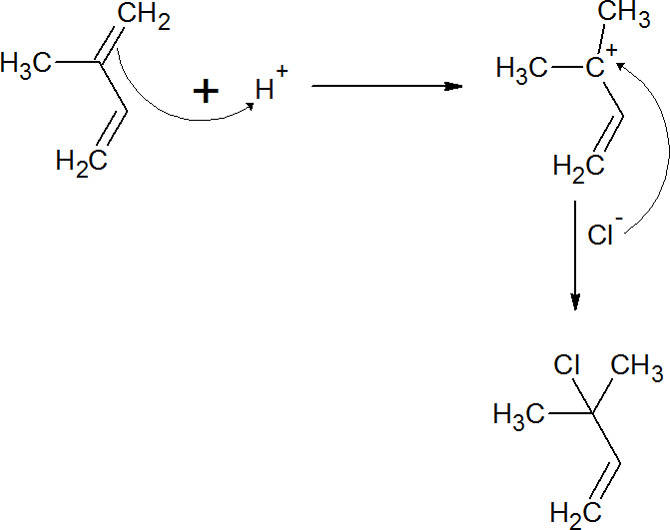
Eliminierungsreaktion
Wie der Name schon verrät, wird bei Eliminierungsreaktionen ein Teil aus einem Molekül abgespalten. Aus einem Ethanmolekül kann also ein Molekül Wasserstoff abgespalten werden. Dadurch werden zwei Bindungsstellen im Molekül frei. Diese befinden sich jeweils an benachbarten Kohlenstoffatomen im Molekül. Um das Defizit an Bindungen auszugleichen, bildet sich zwischen diesen Kohlenstoffatomen eine zusätzliche Bindung aus, sodass eine Kohlenwasserstoffverbindung mit Doppelbindung entsteht.
Aus dem Ethanmolekül ist also durch Eliminierung ein Ethenmolekül geworden. Diese Reaktion läuft nicht freiwillig ab, sie ist endotherm und benötigt somit Energie. Wird aus dem Ethenmolekül ein weiteres Molekül Wasserstoff entfernt, bildet sich wieder eine zusätzliche Bindung aus. Es entsteht eine Dreifachbindung und somit Ethin.
Aus Alkanen und Alkenen kann also Wasserstoff eliminiert werden, wodurch sich eine zusätzliche Bindung zwischen den Kohlenstoffatomen ausbildet. Aus dem Alkan wird ein Alken und aus dem Alken ein Alkin. Alkine können also keine Eliminierungsreaktionen eingehen.
Zusammenfassend lässt sich also sagen, aus Alkanen und Alkenen lassen sich also Wasserstoffmoleküle entfernen und an Alkene und Alkine lässt sich Wasserstoff addieren.
Alle Videos zum Thema
Videos zum Thema
Reaktionsmechanismen der Kohlenwasserstoffe (14 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Reaktionsmechanismen der Kohlenwasserstoffe (14 Arbeitsblätter)
-
 Bindungslänge und Bindungsenergie
PDF anzeigen
Bindungslänge und Bindungsenergie
PDF anzeigen -
 Reaktionstypen der Kohlenwasserstoffe – Überblick
PDF anzeigen
Reaktionstypen der Kohlenwasserstoffe – Überblick
PDF anzeigen -
 Nucleophile Substitution an Kette und Ring
PDF anzeigen
Nucleophile Substitution an Kette und Ring
PDF anzeigen -
 Elektrophile Substitution
PDF anzeigen
Elektrophile Substitution
PDF anzeigen -
 Die Markovnikov-Regel
PDF anzeigen
Die Markovnikov-Regel
PDF anzeigen -
 Nucleophile Addition
PDF anzeigen
Nucleophile Addition
PDF anzeigen -
 Radikalische Addition
PDF anzeigen
Radikalische Addition
PDF anzeigen -
 Die Eliminierungsreaktion
PDF anzeigen
Die Eliminierungsreaktion
PDF anzeigen -
 Kondensationsreaktionen – Überblick
PDF anzeigen
Kondensationsreaktionen – Überblick
PDF anzeigen -
 Polykondensation
PDF anzeigen
Polykondensation
PDF anzeigen -
 Halogenierung
PDF anzeigen
Halogenierung
PDF anzeigen -
 Halogenalkane – Saytzeff- und Hofmann-Produkt (Expertenwissen)
PDF anzeigen
Halogenalkane – Saytzeff- und Hofmann-Produkt (Expertenwissen)
PDF anzeigen -
 Halogenalkane – Sayzew- und Hofmann-Produkt (Vertiefungswissen)
PDF anzeigen
Halogenalkane – Sayzew- und Hofmann-Produkt (Vertiefungswissen)
PDF anzeigen -
 Reaktionsmechanismen mit Umlagerungen
PDF anzeigen
Reaktionsmechanismen mit Umlagerungen
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation




























