Atome und Moleküle
Ein Atom besteht aus einem Atomkern mit Protonen und Neutronen und einer Atomhülle, die die Elektronen enthält. Gehen zwei Atome eine Bindung miteinander ein, dann entstehen Moleküle.
Beliebteste Videos und Lerntexte
Jetzt mit Spass die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Atommodelle
Dalton begründete 1803-1809 die Atomtheorie. Dabei besteht jedes Element aus sehr kleinen, unteilbaren Teilchen: den Atomen. Atome eines Elementes besitzen die gleichen Eigenschaften und lassen sich nicht in Atome anderer Elemente umwandeln. Verbindungen entstehen dann, wenn Atome verschiedener Elemente kombiniert werden.
1911 war Rutherford in der Lage, durch Experimente zu zeigen, dass ein Atom einen Atomkern besitzt. Dieser ist sehr klein und in ihm befinden sich sehr dicht positiv geladene Teilchen. In einem weitaus größeren Teil des Atoms befinden sich die negativ geladenen Teilchen, die um den Kern herumfliegen.
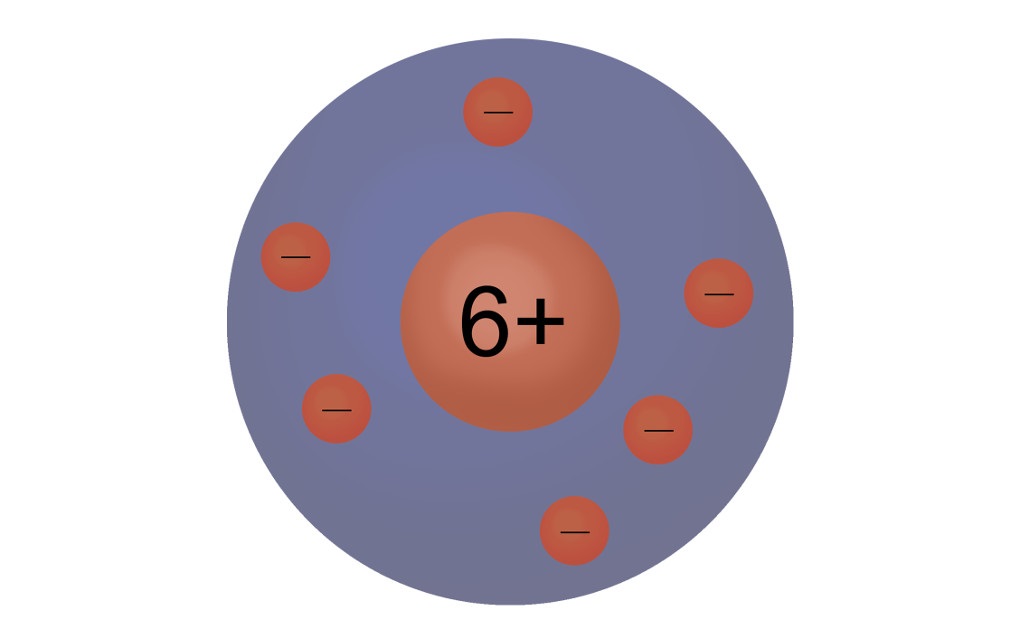
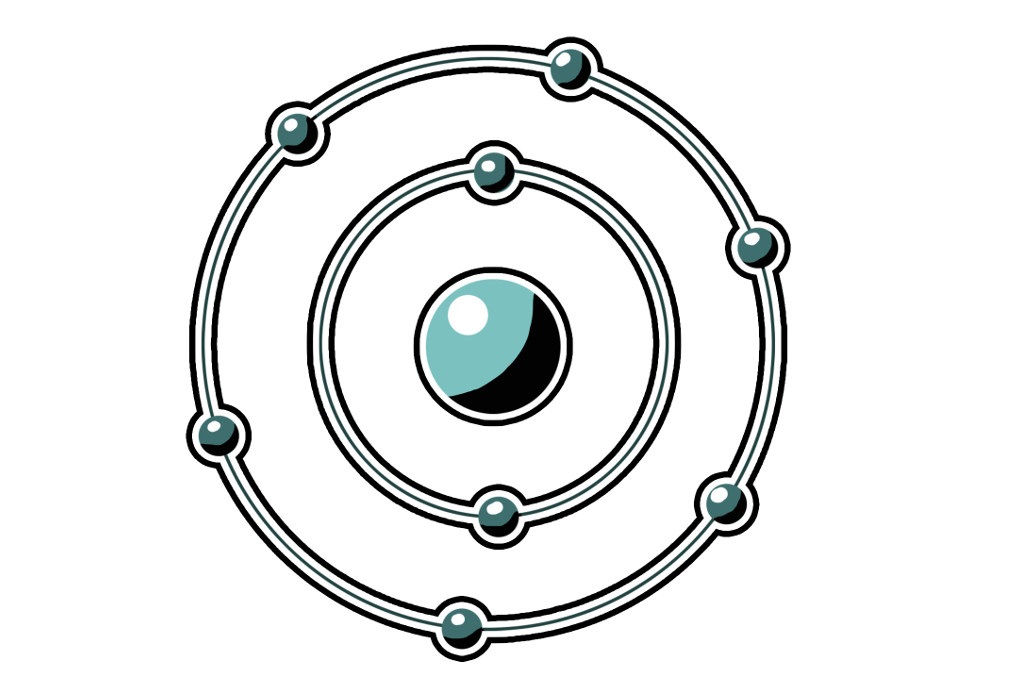
1913 entwickelte dann Niels Bohr das Bohrsche Atommodell, das auch heute noch häufig verwendet wird. Dieses Modell wird auch Schalenmodell oder Zwiebelschalenmodell genannt. Gleich den Schichten einer Zwiebel teilt sich hier die Elektronenhülle in einzelne Schalen auf. Diese Schalen umschließen dabei die innere Schale immer komplett. Auf diesen Schalen bewegen sich dann die Elektronen auf festen Bahnen. Dieses Modell stellt eine Erweiterung des Kern-Hülle-Modells dar, bei diesem war die Elektronenhülle noch nicht unterteilt. Doch auch das in der Chemie so häufig verwendete Bohrsch'e Atommodell stellt noch nicht den Gipfel der Weiterentwicklung dar. Schon seit 1925 haben sich quantenchemische Atommodelle etabliert, in denen die Atombahnen durch Atomorbitale ersetzt werden.
Atomaufbau
Schauen wir uns den Aufbau des Modells von Bohr etwas genauer an. Das Atom besitzt einen Atomkern und eine Atomhülle. Im Atomkern befinden sich die positiven Elementarteilchen, die Protonen und die ungeladenen Teilchen, die Neutronen. In der Atomhülle befinden sich die negativ geladenen Elektronen. Da ein Atom neutral ist, müssen in ihm die Anzahl an positiv geladener Teilchen und negativ geladener Teilchen gleich sein.
Ein Sauerstoffatom zum Beispiel besitzt insgesamt 8 Protonen und demnach auch 8 Elektronen. Auf der ersten Schale können sich maximal zwei Elektronen befinden. Wenn diese voll ist, dann wird die zweite Schale besetzt. Hier finden maximal 8 Elektronen Platz. Die sechs übrigen Elektronen des Sauerstoffatoms befinden sich also auf der zweiten Schale.
Moleküle
Gehen zwei Atome eine chemische Bindung ein, entsteht ein Molekül. Ein Wassermolekül besteht zum Beispiel aus einem Sauerstoffatom und zwei Wasserstoffatomen. Die Atome gehen über ihre Elektronen Bindungen ein.

Die Größe von Molekülen kann dabei ganz unterschiedlich sein. Es gibt sehr kleine Moleküle wie das Wasserstoffmolekül, aber auch sehr große Moleküle wie zum Beispiel das Chlorophyll.

Geometrie in Molekülen
Moleküle besitzen immer eine ganz bestimmte Molekülgeometrie. Voraussagen lässt sich diese durch das EPA-Modell (oder englisch VSEPR-Modell). Die Abkürzung steht für Elektronenpaar-Abstoßungs-Modell. Betrachtet wird dabei die Anzahl der Elektronenpaare um das zentrale Atom. Da sich Elektronenpaare abstoßen, ordnen sich diese so weit entfernt wie möglich an. Betrachtet werden dabei alle Bindungselektronenpaare und alle freien Elektronenpaare.
Schauen wir uns dazu das Methanmolekül an. Um das Kohlenstoffatom befinden sich vier Elektronenpaare, die je eine Bindung zu einem Wasserstoffatom eingehen. Die Geometrie, in der sich die vier Elektronenpaare am weitesten entfernen, ist eine tetraedrische Anordnung. Da alle Elektronenpaare Bindungselektronenpaare sind, ist auch die Geometrie im Molekül tetraedrisch.

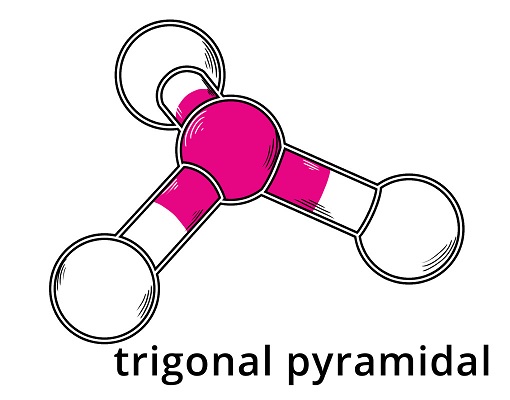
Schauen wir uns im Vergleich Ammoniak an. Auch am zentralen Stickstoffatom befinden sich vier Elektronenpaare. Diese ordnen sich also wieder tetraedrisch an. Da allerdings nur drei der Elektronenpaare auch Bindungselektronenpaare zum Wasserstoff sind, entsteht eine trigonal-pyramidale Anordnung. Das freie Elektronenpaar taucht in der realen Molekülgeometrie also nicht auf, beeinflusst sie aber trotzdem.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Atome und Moleküle (8 Videos, 2 Lerntexte)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Atome und Moleküle (5 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation















 Das Atom – Aufbau aus Elementarteilchen
Das Atom – Aufbau aus Elementarteilchen
 Thomsons Atommodell
Thomsons Atommodell
 Der Aufbau von Atomen – Elektronenschalen
Der Aufbau von Atomen – Elektronenschalen
 Von starren Kugeln zu wirbelnden Wolken – Atommodelle im Überblick
Von starren Kugeln zu wirbelnden Wolken – Atommodelle im Überblick
 EPA-Modell – räumliche Struktur von Molekülen
EPA-Modell – räumliche Struktur von Molekülen












