Alkane
Einfach lernen mit Videos, Übungen, Aufgaben & Arbeitsblättern
Beliebteste Videos und Lerntexte
Jetzt mit Spass die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Die homologe Reihe der Alkane
Die Alkane sind die einfachsten Kohlenwasserstoffe. Sie bestehen aus einer Kette von Kohlenstoffatomen (außer Methan, da es nur ein Kohlenstoffatom besitzt), die mit Einfachbindungen verknüpft sind, und Wasserstoffatomen, die alle freien Bindungsstellen der Kohlenstoffatome besetzen. Kohlenstoff steht im Periodensystem in der 4. Hauptgruppe. Es besitzt also 4 Außenelektronen, die es für Bindungen bereitstellen kann. Wasserstoff besitzt nur ein Elektron und kann daher nur eine Bindung eingehen.
Alkane gleichen sich stark in ihrem Aufbau und Eigenschaften. Daher wurden sie zu einer homologen Reihe zusammengefasst. Die aufeinander folgenden Mitglieder einer homologen Reihe unterscheiden sich durch ein festes Kettenglied. Im Falle der Alkane ist es eine Methylengruppe $-CH_2-$.
Alle Gruppenmitglieder sind außerdem durch eine allgemeine Summenformel darstellbar. Für die offenkettigen Alkane lautet sie $C_xH_{2x+2}$. Wenn du für x die gewünschte Zahl an Kohlenstoffatomen einsetzt, kannst du schnell berechnen, wie viele Wasserstoffatome das gesuchte Alkan beinhaltet.
Eigenschaften der Alkane
Alkane bestehen aus Kohlenstoff- und Wasserstoffatomen. Die Differenz der Elektronegativität zwischen diesen Elementen ist mit 0,3 recht niedrig. Es liegt daher eine unpolare Atombindung vor. Aus diesem Grund können keine Wasserstoffbrückenbindungen aufgebaut werden. Der intermolekulare Zusammenhalt beruht aus diesem Grund nur auf den Anziehungskräften der Ketten untereinander, den sogenannten Van-der-Waals-Kräften. Die Van-der-Waals-Kräfte sind recht gering und summieren sich mit größer werdender Kettenlänge auf.
Daraus können nun Eigenschaften abgeleitet werden. Alkane besitzen einen niedrigen Siedepunkt, der mit zunehmender Kettenlänge steigt. Aus diesem Grund sind die Alkane von Methan bis Butan gasförmig. Ab 5 Kohlenstoffatomen sind Alkane flüssig und ab 17 fest.
Da die Bindung zwischen Kohlenstoff und Wasserstoff aber recht stabil ist, sind Alkane im Allgemeinen reaktionsträge. Es benötigt eine hohe Aktivierungsenergie und/oder geeignete Katalysatoren, um sie zur Reaktion zu bringen. Trotzdem sind Alkane brennbar.
Nomenklatur der Alkane
Damit Forschungsergebnisse ausgetauscht und fachliche Diskussionen geführt werden können, war eine einheitliche Bezeichnung von großen organischen Molekülen unumgänglich. Daher wurden die IUPAC-Regel aufgestellt. Die Alkane erhalten einheitlich die Endung -an. Diese Endung zeigt an, dass in dem Aufbau von Kohlenwasserstoff nur Einfachbindungen enthalten sind. Für die Anzahl der Kohlenstoffatome wurden Zahlwörter eingeführt. So steht zum Beispiel Meth- für ein C-Atom und Prop- für 3 C-Atome.
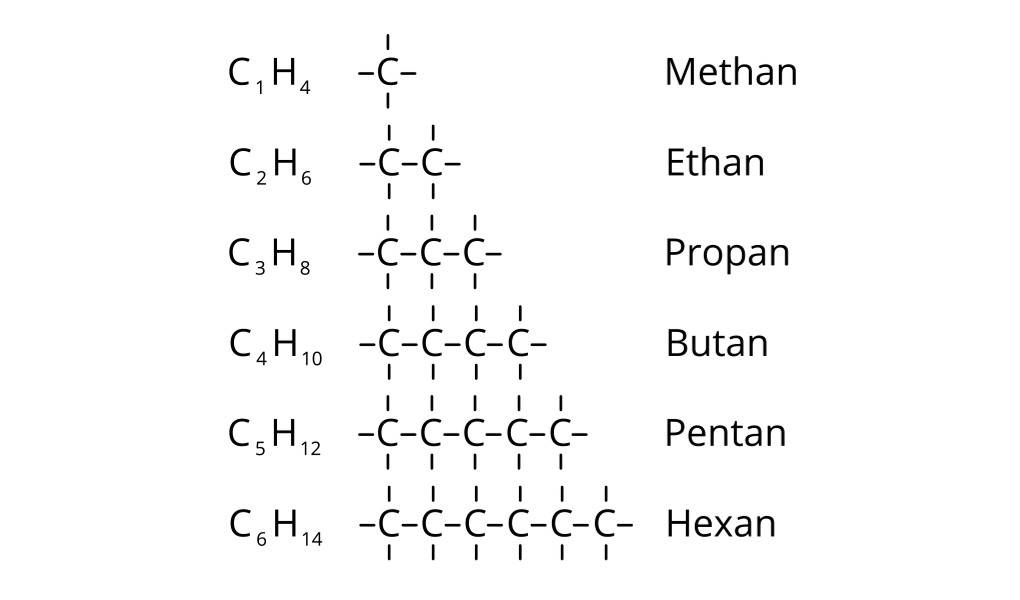
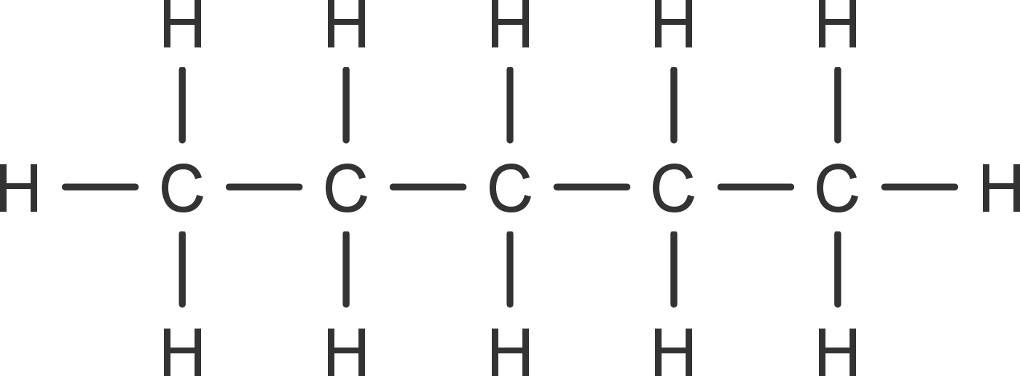
Mit Hilfe der Nomenklatur kannst du also immer vom Namen auf die Struktur des Moleküls schließen. Der Name Pentan verrät dir, dass es sich um eine Kette von fünf Kohlenstoffatomen handelt, die mit Einfachbindungen verknüpft ist. Die Anzahl an Wasserstoffatomen ermittelst du mit der allgemeinen Summenformel $C_xH_{2x+2}$.
Reaktionen
Alkane sind brennbar. Sie können also oxidiert werden. Aus diesem Grund werden beispielsweise die gasförmigen Vertreter Butan und Propan in Feuerzeugen und Gasbrennern benutzt.
Verbrennt ein Alkan vollständig, d.h. mit genügend Sauerstoff, bilden sich ausschließlich die Reaktionsprodukte Wasser und Kohlenstoffdioxid. Steht nicht ausreichend Sauerstoff zur Verfügung, ist die Verbrennung unvollständig und es entstehen zusätzlich Kohlenstoffmonoxid und Ruß (elementarer Kohlenstoff).

Allgemein sind die Alkane aber reaktionsträge. Sie reagieren weder mit unedlen Metallen, noch mit Säuren oder Basen. Sie gehen aber Substitutionsreaktionen ein. Diese kann zum Beispiel mit Halogenen wie Chlor ablaufen. Dabei wird ein Wasserstoffatom durch ein Halogenatom ersetzt. Es entsteht ein Halogenalkan und Halogenwasserstoff. Hier siehst du die Reaktion von Hexan mit Chlor.
$CH_3-(CH_2)_4-CH_3 + Cl_2 \rightarrow CH_2Cl-(CH_2)_4-CH_3 + HCl$
Zusammenfassend lässt sich also sagen, dass Alkane Kohlenwasserstoffe mit Einfachbindungen sind. Sie besitzen eine allgemeine Summenformel und die Vertreter unterscheiden sich durch feste Einheiten (Methylengruppe) voneinander. Alkane sind reaktionsträge und weisen vorwiegend Van-der-Waals-Kräfte auf. Sie können oxidiert werden und gehen Substitutionsreaktionen ein.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Alkane (10 Videos, 2 Lerntexte)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Alkane (9 Arbeitsblätter)
-
 Kohlenwasserstoffe – Einführung
PDF anzeigen
Kohlenwasserstoffe – Einführung
PDF anzeigen -
 Eigenschaften der Alkane
PDF anzeigen
Eigenschaften der Alkane
PDF anzeigen -
 Nomenklatur der Alkane
PDF anzeigen
Nomenklatur der Alkane
PDF anzeigen -
 Reaktionen der Alkane – radikalische Substitution
PDF anzeigen
Reaktionen der Alkane – radikalische Substitution
PDF anzeigen -
 Nomenklatur von Alkanen (Übungsvideo 1)
PDF anzeigen
Nomenklatur von Alkanen (Übungsvideo 1)
PDF anzeigen -
 Reaktionen der Alkane – Homolytischer und heterolytischer Bindungsbruch
PDF anzeigen
Reaktionen der Alkane – Homolytischer und heterolytischer Bindungsbruch
PDF anzeigen -
 Verbrennung von Alkanen
PDF anzeigen
Verbrennung von Alkanen
PDF anzeigen -
 Was sind Halogenkohlenwasserstoffe?
PDF anzeigen
Was sind Halogenkohlenwasserstoffe?
PDF anzeigen -
 Thiole und Thioether
PDF anzeigen
Thiole und Thioether
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation





























