Reaktion am Aromaten
Aromaten bevorzugen die elektrophile Substitution.
Beliebteste Videos
Jetzt mit Spass die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Nitrierung von Benzol
Wie funktioniert die Nitrierung von Benzol? Das Benzolmolekül stellt einen klassischen Aromaten dar. Das organische Molekül besitzt eine geschlossene Ringstruktur und ist planar. Zwischen den Kohlenstoff-Atomen, die den Ring bilden, wechseln sich Einfach- und Doppelbindungen ab, sie sind also konjugiert. Es sind somit sechs $\pi$-Elektronen vorhanden. Diese sind innerhalb des Rings nicht an eine bestimmte Stelle gebunden. Man spricht hier von delokalisierten $\pi$-Elektronen. Daher schreibt man das Molekül auch oft mit einem Kreis in der Mitte, der dieses Elektronensextett darstellen soll.
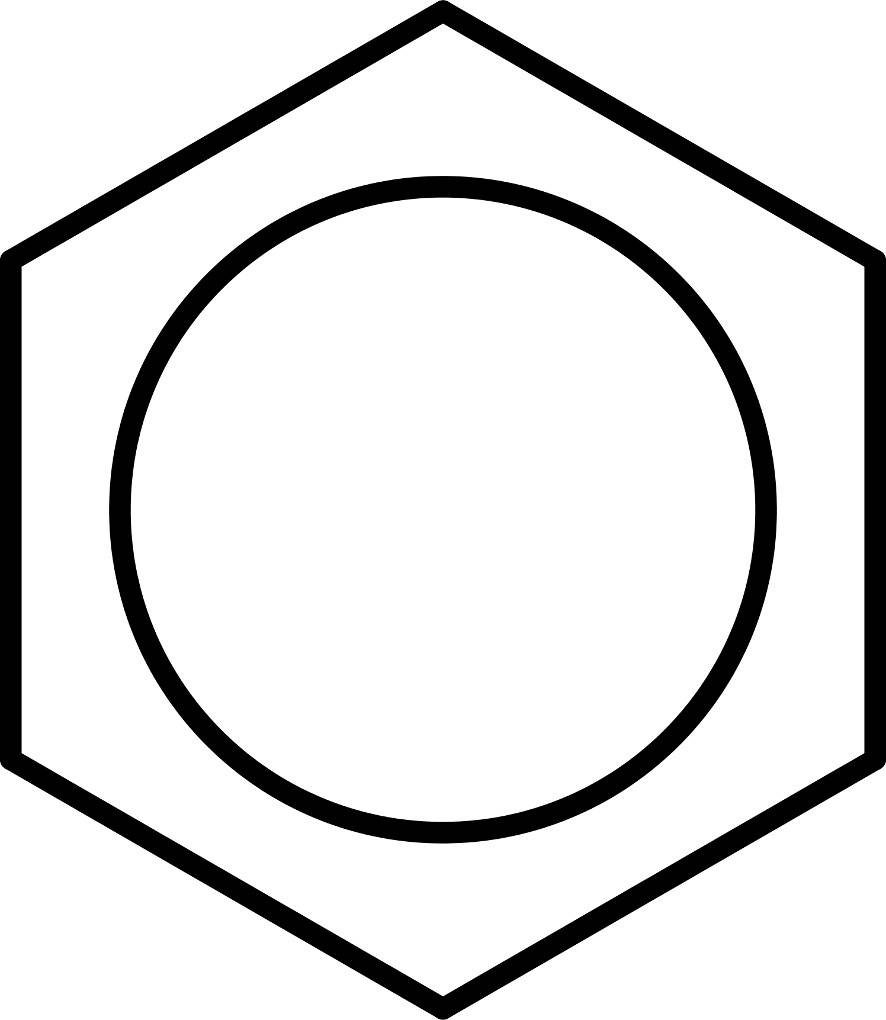
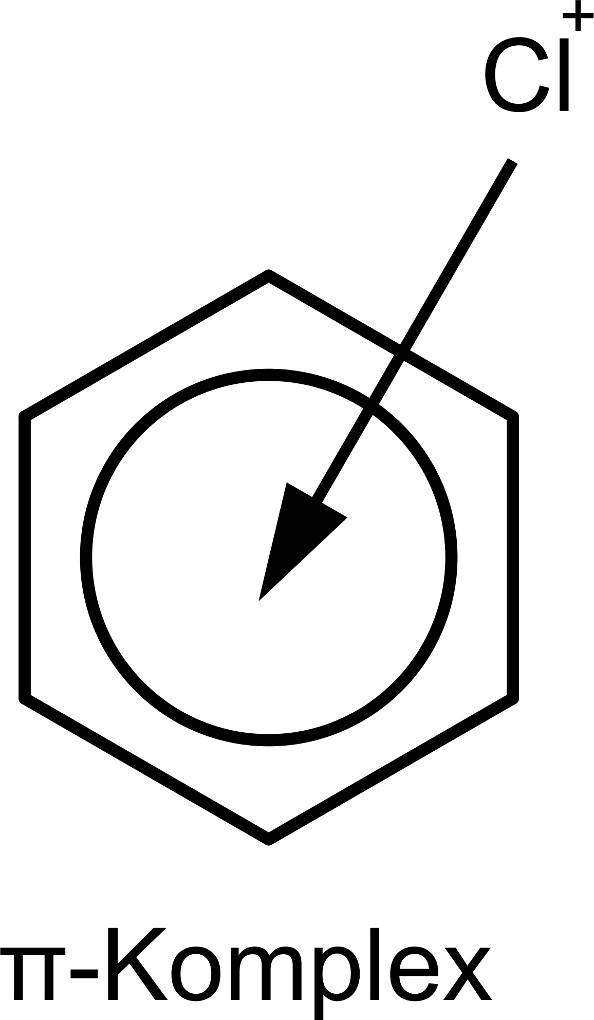
Aufgrund dieses Elektronensextetts ist die Elektronendichte innerhalb des Rings relativ hoch. Dies macht den Angriff von Elektrophilen möglich. Elektrophile sind Teilchen, die angezogen werden von negativen Ladungen. Im Beispiel der Nitrierung ist das Elektrophil ein Nitronium-Ion $({NO_2}^+)$. Dieses kann aus einer Mischung von Salpetersäure und Schwefelsäure gewonnen werden. Man nennt dieses Gemisch daher auch Nitriersäure. Bei der Nitrierung handelt es sich um eine elektrophile Substitution. Dabei greift das Nitronium-Ion das Benzolmolekül an. Es bildet sich zuerst ein $\pi$-Komplex. Dabei wechselwirken die $\pi$-Elektronen des Benzols mit dem Elektrophil. Dabei besteht noch keine echte Bindung zwischen den beiden Teilchen. Hier siehst du einen $\pi$-Komplex mit einem Chlor-Elektrophil.
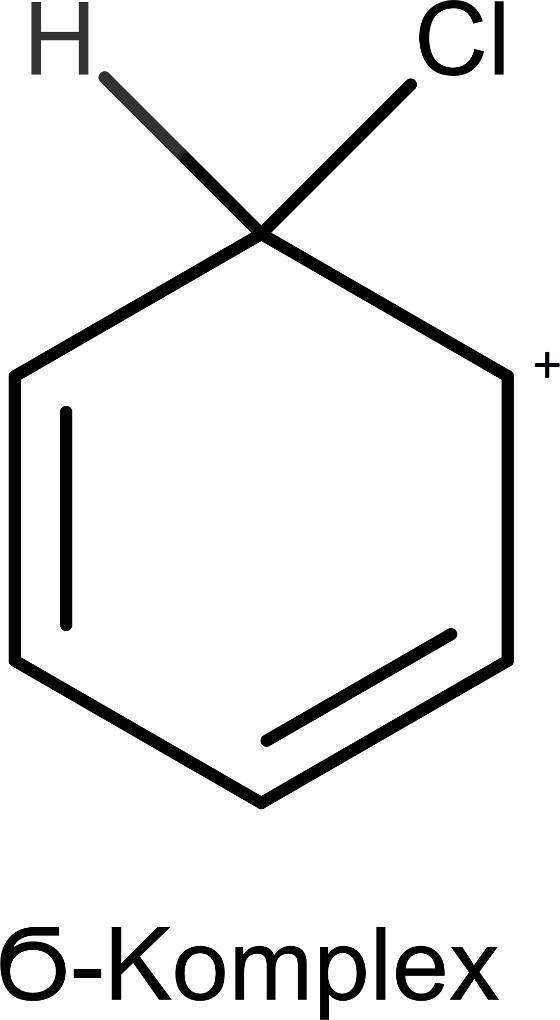
Nach diesem Schritt bildet sich ein $\sigma$-Komplex heraus. Dabei hat sich eine kovalente Bindung zum Elektrophil ausgebildet und auch das Wasserstoff-Atom ist noch gebunden.
Als letzter Schritt erfolgt die Abspaltung des Wasserstoffs. Die Substitution des Wasserstoffs durch eine Nitrogruppe ist nun abgeschlossen. Das entstandene Produkt wird als Nitrobenzol bezeichnet.
Friedel-Crafts-Acylierung
Auch die Friedel-Crafts-Acylierung ist eine elektrophile Substitution an einem Aromaten. Bei dieser Reaktion wird ein Acyl-Rest an einen Aromaten substituiert. Ein Acyl-Rest leitet sich von Carbonsäuren und Aldehyden ab. Dabei bleibt die Carbonyl-Gruppe ($C=O$) bestehen, während die Hydroxyl-Gruppe bzw. bei Aldehyden das Wasserstoff-Atom durch einen organischen Rest wie z.B. eine Methyl-Gruppe ersetzt ist. Ein einfacher Acyl-Rest ist z.B. $CH_3-CO-$. Auch aromatische Acyl-Reste sind möglich.
Als Erstes muss ein Acytyl-Ion erzeugt werden. Dieses besitzt dann eine positive Ladung und kann den Aromaten mit seiner hohen Elektronendichte angreifen. Der Reaktionsmechanismus verläuft wie bei der Nitrierung. Es erfolgt also die Bildung eines $\pi$-Komplexes. Daraus entsteht ein $\sigma$-Komplex und zum Schluss erfolgt die Abspaltung des Protons. Mithilfe dieser Reaktion können gezielt Substituenten an Aromaten angebracht werden. So werden Verbindungen hergestellt, die genau dem gewünschten Verwendungszweck entsprechen.
Zweitsubstitution am Aromaten
Wenn man einen weiteren Substituenten an einem Aromaten anbringen will (Zweitsubstitution), ist der bereits vorhandene Substituent zu berücksichtigen. Je nach Art dieses Substituenten wird der Folgende in eine bestimmte Position am Ring dirigiert. Es gibt die ortho- (direkt neben dem Substituenten), meta- (eine Position weiter) und die para-Stellung (genau gegenüber und damit am weitesten entfernt vom Substituenten). Hier siehst du das Beispiel ortho-Nitrotoluol.
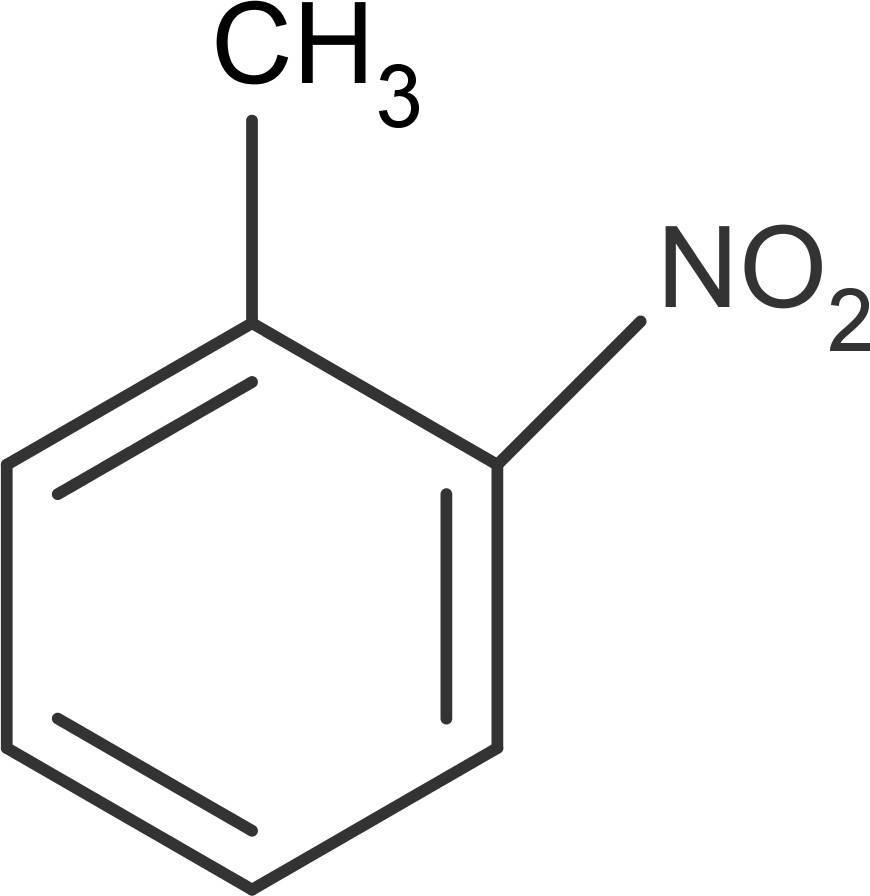
Man unterscheidet daher Substituenten erster Ordnung und zweiter Ordnung. Die der ersten Ordnung, wie die Methyl-Gruppe, dirigieren weitere Substituenten in die ortho- oder para-Stellung. Substituenten der zweiten Ordnung, wie die Nitro-Gruppe, bewirken die Anlagerung eines weiteren Substituenten in der meta-Stellung.
Alle Videos zum Thema
Videos zum Thema
Reaktion am Aromaten (5 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Reaktion am Aromaten (3 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation









 Nitrierung von Benzol
Nitrierung von Benzol
 Funktionalisierte Aromaten und ihr Reaktionsverhalten
Funktionalisierte Aromaten und ihr Reaktionsverhalten
 Zweitsubstitution am Aromaten
Zweitsubstitution am Aromaten












