Estergleichgewicht

in nur 12 Minuten? Du willst ganz einfach ein neues
Thema lernen in nur 12 Minuten?
-
 5 Minuten verstehen
5 Minuten verstehen
Unsere Videos erklären Ihrem Kind Themen anschaulich und verständlich.
92%der Schüler*innen hilft sofatutor beim selbstständigen Lernen. -
 5 Minuten üben
5 Minuten üben
Mit Übungen und Lernspielen festigt Ihr Kind das neue Wissen spielerisch.
93%der Schüler*innen haben ihre Noten in mindestens einem Fach verbessert. -
 2 Minuten Fragen stellen
2 Minuten Fragen stellen
Hat Ihr Kind Fragen, kann es diese im Chat oder in der Fragenbox stellen.
94%der Schüler*innen hilft sofatutor beim Verstehen von Unterrichtsinhalten.
Grundlagen zum Thema Estergleichgewicht
Veresterung ist die Reaktion einer Säure mit einem Alkohol zu einem Ester und Wasser. Der Gleichgewichtszustand liegt vor, wenn die Geschwindigkeiten von Hin- und Rückreaktion gleich sind. Das Estergleichgewicht lässt sich elegant durch die Anwendung des Massenwirkungsgesetzes beschreiben. Bei der Reaktion von Ethanaol mit Ethansäure beträgt die Gleichgewichtskonstante etwa 4. Der quantitative Zusammenhang der Konzentrationen kann in der Analytik für die Berechnung von Gleichgewichtswerten (Ausbeuterechnungen, Umsatz) benutzt werden. Wie das genau geht wird euch in diesem video erläutert.
Transkript Estergleichgewicht
Guten Tag und herzlich willkommen. In diesem Video geht es um das Estergleichgewicht. Der Film ist vorgesehen für das Gymnasium, die Kursphase und den dortigen Grundkurs. Der Film ist folgendermaßen gegliedert: 1. Veresterung 2. Gleichgewichtsreaktion 3. Massenwirkungsgesetz 4. Analytik 5. Zusammenfassung 1. Veresterung Die Veresterung in der organischen Chemie ist die Reaktion einer Carbonsäure mit einem Alkohol. Hier soll Ethansäure (Essigsäure) mit Ethanol (Alkohol) reagieren. Die Reaktion läuft unter saurer Katalyse ab. Von der Ethansäure spaltet sich eine OH-Gruppe ab. Vom Ethanol spaltet sich ein Wasserstoffatom ab. Es bildet sich ein Ester und Wasser. Der Ester hier ist Ethylacetat, HOH ist Wasser. Allgemein reagieren Säure+Alkohol zu Ester und Wasser. Ich werde im Weiteren Abkürzungen verwenden: S+A->E+W. 2. Gleichgewichtsreaktion S+A->E+W. Diese Reaktion beschreibt die Esterbildung. Auch die umgekehrte Reaktion ist möglich: E+W->S+A. Das ist der Esterzerfall. Die Esterbildung läuft mit einer Geschwindigkeit von VH ab. Das ist die Geschwindigkeit der Hinreaktion. Der Esterzerfall läuft mit einer Geschwindigkeit von VR ab. Das ist die Geschwindigkeit der Rückreaktion. Wenn die Geschwindigkeiten VH und VR gleich sind, ist das chemische Gleichgewicht dieser Reaktion erreicht. 3. Massenwirkungsgesetz Das Massenwirkungsgesetz für den Gleichgewichtszustand der Veresterung lautet: ([E]×[W])/([S]×[A])=K. K ist die Gleichgewichtskonstante. Die eckigen Klammern bedeuten, dass es sich um Konzentrationen handelt. Die Gleichgewichtskonstante ist eine Konstante - sie hängt nur ab von der Temperatur. Für die unter 1.) dargestellte Reaktion beträgt die Gleichgewichtskonstante 4 bei einer Temperatur von 25 °C. Betrachten wir dazu einige Beispiele. Ich möchte daran erinnern, dass die Konzentrationen in der Chemie in mol/l ausgedrückt werden. Die Konzentration des Esters soll 6 mol/l betragen, die Konzentration des Wassers 4 mol/l, die Konzentration der Säure 3 mol/l und die Konzentration des Alkohols 2 mol/l. Es wäre auch der Fall 14 - 10 - 5 - 7 möglich, jeweils in mol/l. Auch 1 - 10 - 2,5 - 1 sind denkbar. Man erhält jeweils 4. 4. Analytik Wir wollen hier betrachten, wie man die Konzentration des Esters ([E]) berechnen kann. Zu Beginn der Reaktion sei die Konzentration der Säure 10 mol/l, die Konzentration des Alkohols 2 mol/l, die Konzentration des Esters ist dann 0 mol/l und die Konzentration des Wassers ebenfalls 0 mol/l, denn es haben sich ja noch keine Reaktionsprodukte gebildet. Nach Einstellung des chemischen Gleichgewichts beträgt die Konzentration der Säure [10-x] mol/l, die Konzentration des Alkohols [2-x] mol/l, die Konzentration des Esters und des Wassers jeweils [x] mol/l. Wir setzen nun diese Terme in das Massenwirkungsgesetz ein: x2/((10-x)×(2-x))=4. Die Umformung dieser Bruchgleichung führt auf eine quadratische Gleichung. Die sinnvolle Lösung ergibt x=1,89. Also die Konzentration des Esters [E] beträgt 1,89 mol/l. Zusammenfassung Wir haben die Reaktion Säure+Alkohol->Ester+Wasser als Gleichgewichtsreaktion betrachtet. Die Konzentration der Säure, des Alkohols, des Esters und des Wassers sind bei Einstellung des chemischen Gleichgewichtes konstant. Die Anwendung des Massenwirkungsgesetzes auf dieses Gleichgewicht ergibt: ([E]×[W])/([S]×[A])=K. K ist die Gleichgewichtskonstante, für die von uns betrachtete Reaktion =4. Das Massenwirkungsgesetz kann in der Analytik für verschiedene Dinge verwendet werden, z. B. für die Berechnung der Konzentration des Esters ([E]), also für Umsatzberechnungen. Ich danke für die Aufmerksamkeit. Alles Gute. Auf Wiedersehen.
Estergleichgewicht Übung
-
Fasse die Informationen über die Esterbildung zusammen.
TippsDie organische Chemie ist ein Teilgebiet der Chemie, in der Verbindungen mit Kohlenstoff ($C$) behandelt werden.
Achte auf die unterschiedlichen Endungen der Stoffe.
Alkohole haben im Namen immer das -ol als Kürzel.
LösungEster gehören zur organischen Chemie. Sie enthalten Kohlenstoff, Wasserstoff und Sauerstoff. Es reagiert immer ein Alkohol mit einer Carbonsäure. Dabei reagiert $OH$ aus der Carboxygruppe $(-COOH)$ der Säure mit dem $H$ aus der Hydroxygruppe $(-OH)$ des Alkohols zu Wasser und der Ester entsteht. Der Reaktionsmechanismus ist komplexer und läuft säurekatalysiert ab. Wusstest du, dass bestimmte Ester wie Früchte riechen? Der Butansäureethylester, gebildet aus der Butansäure und Ethanol, riecht nach Ananas.
-
Definiere das Massenwirkungsgesetz.
TippsDas Massenwirkungsgesetz besagt, dass K gleich dem Quotienten aus dem Produkt der Produkte und dem Produkt der Edukte ist.
Faktoren können vertauscht werden.
K ist von etwas abhängig.
LösungDas Massenwirkungsgesetz gibt dir das Verhältnis der Konzentrationen von Edukten und Produkten im Gleichgewicht an. Ist bei einer Reaktion die Geschwindigkeit der Hinreaktion gleich der Geschwindigkeit der Rückreaktion, befindet sich die Reaktion im Gleichgewicht. Das Verhältnis der Konzentrationen ist konstant und wird durch die Konstante K angegeben. Diese ist temperaturabhängig.
K = 4 wird erhalten, wenn die Konzentrationen der Produkte multipliziert und durch das Produkt der Edukte geteilt werden. Jedoch kannst du die Faktoren vertauschen.
-
Bestimme die Namen der Ester.
TippsMan beginnt immer mit der Säure.
LösungEster werden benannt, indem man zuerst den Namen der Carbonsäure, z.B. Ethansäure, angibt und dann die Bezeichung des Alkyrests, z.B. -ethyl, mit der Endung -ester anhängt.
Durch diese systematischen Namen lässt sich leicht auf die Struktur schließen. Einige Ester haben aber auch Trivialnamen, weil sie häufig in Industrie und Labor verwendet werden. Ethansäureethylester wird zum Beispiel meist nur Ethylacetat genannt.
-
Bestimme die funktionellen Gruppen und Strukturmerkmale.
TippsDie $-OH$-Gruppe gehört zu den Alkoholen.
Die $-COOH$-Gruppe gehört zu den Carbonsäuren.
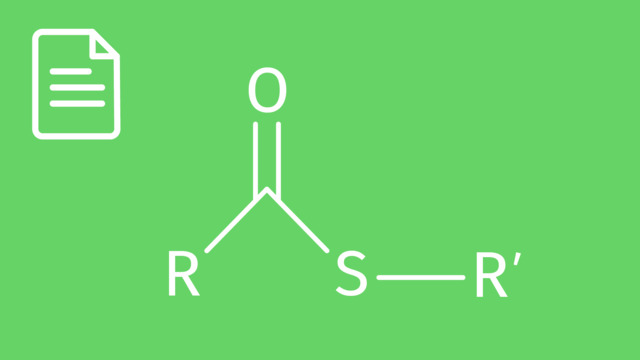
LösungDie Ester Gruppe ist die $-COO$-Gruppe mit einer Doppelbindung zu einem der Sauerstoffatome. Sie bildet sich durch Kondensation einer Carboxygruppe mit einer Hydroxygruppe. Bei der Kondensation wird ein Molekül Wasser frei.
Um Verbindungen zu erkennen und richtig zu benennen, ist es wichtig die strukturellen Merkmale zu kennen.
Übrigens: Die $-CHO$-Gruppe, die nicht zugeordnet werden musste, ist die Aldehydgruppe.
-
Bestimme die Edukte, die zu einem Ester reagieren.
TippsÜberlege, welche zwei Komponenten miteinander reagieren müssen, damit ein Ester entsteht.
Einen Alkohol erkennst du an der Endung -ol.
Überlege, ob Salzsäure die Carboxylgruppe enthält.
LösungEs reagieren immer eine Carbonsäure $($eine Säure mit der funktionellen Gruppe $-COOH)$ und ein Alkohol zu einem Ester. Einen Alkohol erkennst du ganz leicht an der Endung -ol. Achte darauf, dass du die Alkohole nicht mit den Alkanen verwechselst, welche die Endung -al haben.
-
Ermittle die Konzentration des Esters bei 25 °C.
TippsDu kannst den Divisior mit dem Quotienten multiplizieren, damit das $x^2$ auf einer Seite steht.
Nutze die p-q-Formel.
K=4 bei 25 °C
LösungHier siehst du die einzelnen Schritte:
- $\frac{x^2}{(4-x)\cdot(2-x)}=4$
- $\frac{x^2}{x^2-6x+8}=4$
- $4\cdot(x^2-6x+8)=x^2$
- $3x^2-24x+32=0$ $/\div3$
- $x^2-8x+10,7=0$
- $4-\sqrt{16-10,7}=1,7$
9'178
sofaheld-Level
6'600
vorgefertigte
Vokabeln
7'642
Lernvideos
35'607
Übungen
32'354
Arbeitsblätter
24h
Hilfe von Lehrkräften

Inhalte für alle Fächer und Schulstufen.
Von Expert*innen erstellt und angepasst an die Lehrpläne der Bundesländer.
Testphase jederzeit online beenden
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation




 5 Minuten verstehen
5 Minuten verstehen
 5 Minuten üben
5 Minuten üben
 2 Minuten Fragen stellen
2 Minuten Fragen stellen

 Bereit für eine echte Prüfung?
Bereit für eine echte Prüfung?
















Ich denke, dass klar ist,wie die Bruchgleichung für das gewählte Beispiel entsteht.
Dann muss man etwas arbeiten. Äquivalentes Umformen, Lösen der quadratischen Gleichung und Auswahl EINER LÖSUNG. Die zweite Lösung ist entweder negativ oder positiv, aber nicht sinnvoll, da unmöglich (es bildet sich zu viel Produkt).
Dieses Video ist eine Anleitung zum Handeln und KEIN AUFGABENVIDEO.
Alles Gute
Anfangs war es echt gut aber am ende versteht man wieder nicht wie man nun x umgewandelt hat.
Komisch dass dies nicht mit erklärt da dies ja zur lösung führt.
Deswegen meine Frage:
Wie haben Sie x am Ende umgewandelt? Damit man die ganzen nicht bekannten Zahlen ausrechnen kann?
Genial gutes Video, vielen Dank. Hat mir sehr gut geholfen die Grundlagen aufzufrischen.
Gruß