Batterien und Akkumulatoren
Ohne Batterien und Akkumulatoren würde heute kein mobiles Gerät funktionieren, doch wie stellen diese Speichermedien die Stromversorgung bereit?
Beliebteste Videos
Jetzt mit Spass die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Galvanische Zelle
Die galvanische Zelle ist ein technischer Aufbau zur Umwandlung von chemischer Energie in elektrische Energie durch eine Redoxreaktion. Sie besteht aus 2 Halbzellen. Exemplarisch siehst du hier das Daniell-Element.
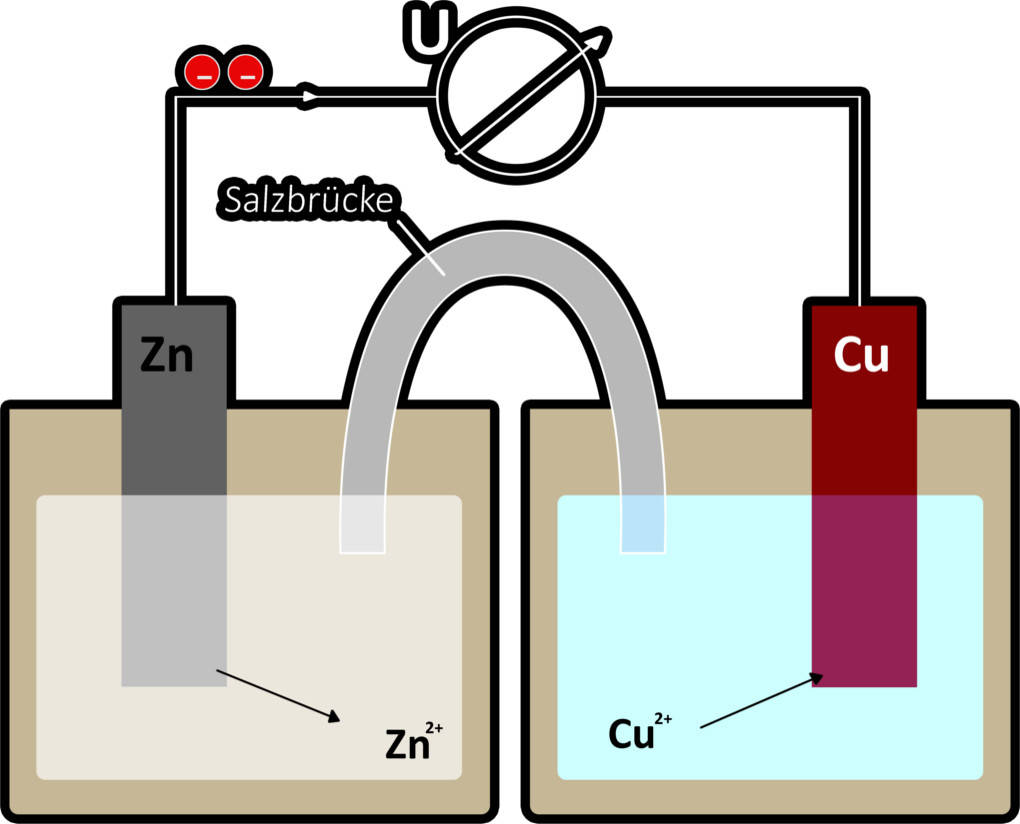
Dies ist eine spezielle galvanische Zelle, die auf John Federic Daniell zurück geht. Die eine Halbzelle ist eine Zink-Halbzelle. Sie besteht aus einer Zink-Elektrode und der Lösung eines Zinksalzes. In der Lösung befinden sich also Zink(II)-Ionen $(Zn^{2+})$. Die andere Halbzelle ist eine Kupfer-Halbzelle. Sie besteht aus einer Kupfer-Elektrode und einer Kupfersalz-Lösung. Beide Halbzellen sind über einen Stromleiter miteinander verbunden. Auf dieser Verbindung bewegen sich die Elektronen. Damit der Stromkreis geschlossen ist, benötigt die galvanische Zelle aber noch eine Salzbrücke. Über diese geschieht ein Ionenausgleich zwischen den beiden Lösungen.
In einer galvanischen Zelle reagiert das unedlere Metall immer als Anode, d.h., das unedlere Metall wird oxidiert. Hier ist es die Zink-Elektrode. Die Reaktion sieht folgendermaßen aus.
$Zn \longrightarrow~Zn^{2+} + 2~e^-$.
Von der Anode aus fließen die Elektronen in Richtung der Kathode. Daher ist die Anode hier der Minuspol. Die Kathode ist der Ort der Reduktion. Das edlere Metall, im Fall des Daniell-Elements Kupfer, nimmt die Elektronen auf und wird somit reduziert. An der Elektrode lagert sich elementares Kupfer ab.
$Cu^{2+} + 2~e^-\longrightarrow~Cu$
Infolge dieser Reaktionen verändert sich die Konzentration der Kationen in den Lösungen der Halbzellen. Daher ist es nötig, dass sich die Konzentration der Anionen in diesen Lösungen ebenfalls ändert. Von der Kupferhalbzelle gelangen aus diesem Grund Anionen durch die Salzbrücke in die Lösung der Zink-Halbzelle.
Die entstehende Spannung einer galvanischen Zelle kann man mittels der Standardelektrodenpotentiale berechnen. Diese findest du in der elektrochemischen Spannungsreihe. In dieser sind Metalle und andere Verbindungen nach ihrem Standardelektrodenpotential geordnet. In dieser Tabelle findest du auch die Informationen, ob ein Metall edler ist als das andere.
Batterien
Batterien stellen eine Anwendung der galvanischen Zelle dar. Sie dient dazu, elektrische Energie mobil nutzbar zu machen. Der Begriff Batterie beschränkt sich im eigentlichen Sinne auf nicht wieder aufladbare Zellen, aber auch Akkus werden heutzutage als Batterien bezeichnet. Mithilfe von Batterien können mobile Geräte mit elektrischem Strom versorgt und auch Geräte am Stromnetz vor einem Stromausfall geschützt werden. Die Schwierigkeit, die es bei der Batterie zu lösen gilt, ist die kompakte Größe. Die entstehenden Reaktionsprodukte müssen in der Batterie Platz haben. So sieht eine Batterie im Inneren aus.
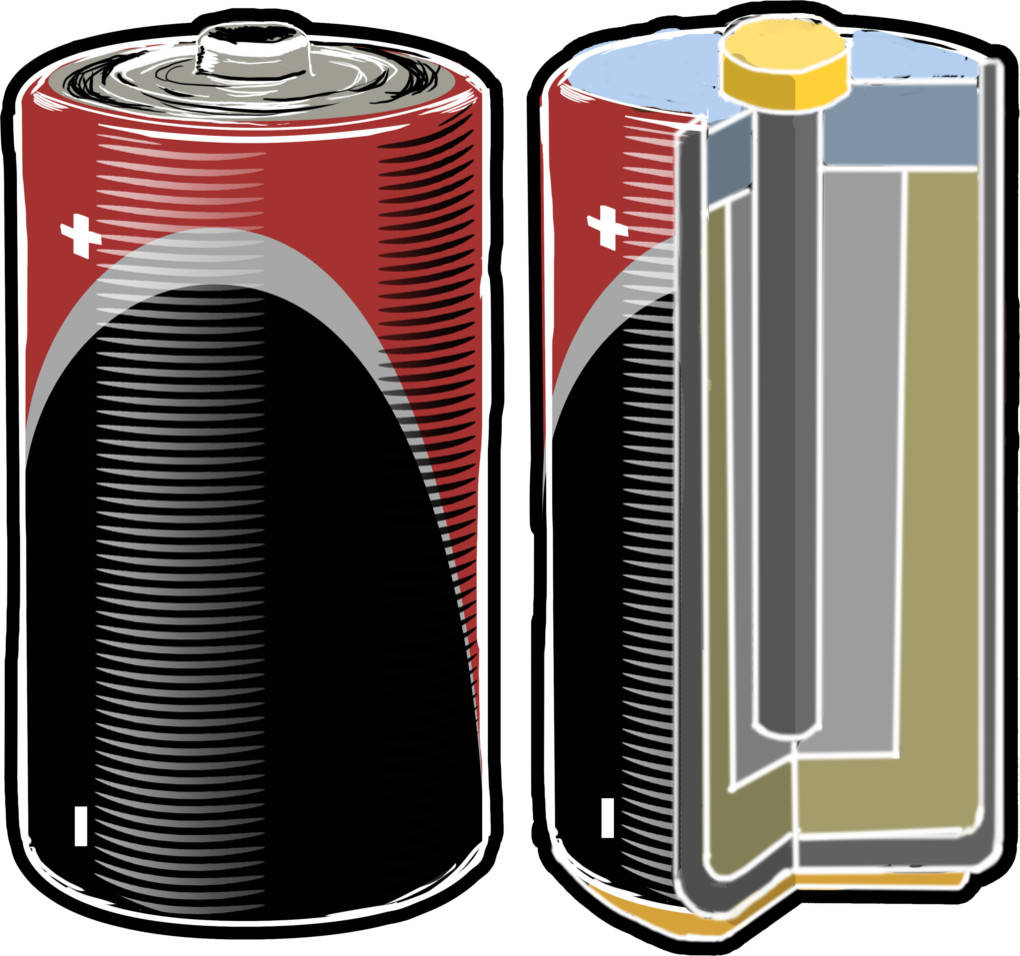
Es gibt verschiedene Arten von Batterien. Genannt seien hier die Zink-Kohle-Batterie und Alkali-Mangan-Batterien. Für den Einsatz in verschiedensten Geräten gibt es Batterien in vielen verschiedenen Größen. Diese reichen von kleinen Knopfzellen über die oft benutzten AA-Batterien bis zu großen Speicherbatterien.
Akkumulatoren
Eine Sonderform der Batterien sind die Akkumulatoren. Sie sind wiederaufladbar. Das bedeutet die Redoxreaktion, die Strom erzeugt hat, ist umkehrbar. Durch das Anlegen einer elektrischen Spannung läuft die Rückreaktion ab und der Akku kann wieder Strom liefern. Dieser Vorgang wird Elektrolyse genannt. Ein sehr bekannter Akku ist die Autobatterie. Sie ist ein Bleiakkumulator.
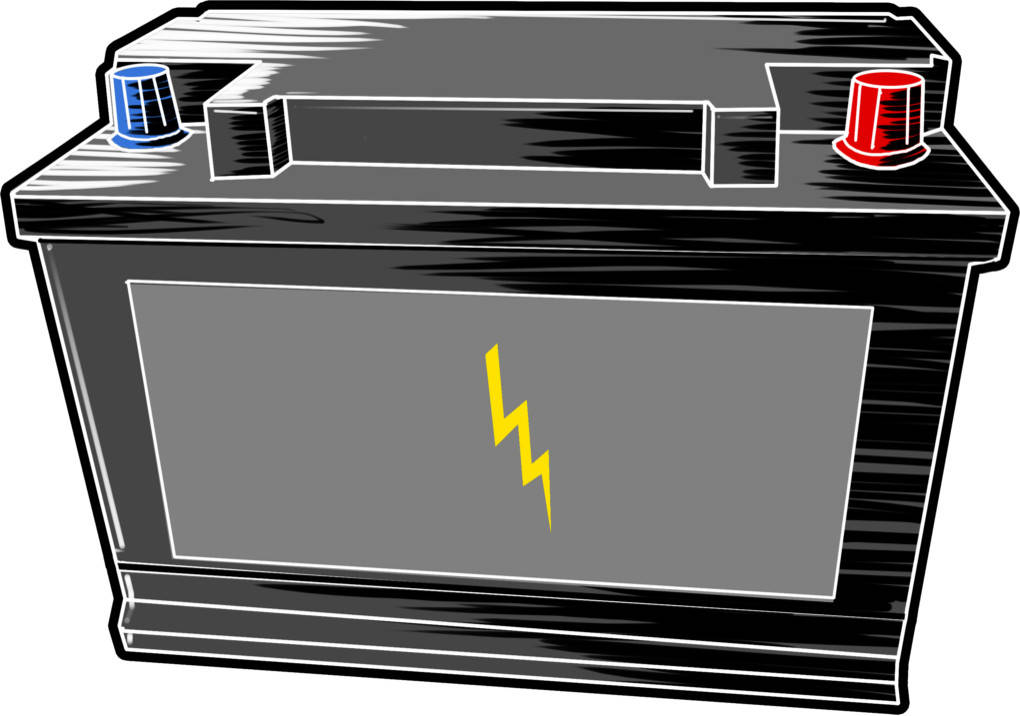
Bleiakkumulatoren bestehen aus Blei und Blei(IV)-Oxid. Der Elektrolyt innerhalb des Akkus ist verdünnte Schwefelsäure. Bleiakkus eignen sich gut als Starterbatterie für Fahrzeuge, da sie kurzzeitig hohe Stromstärken zulassen. Außerdem sind sie kostengünstig und relativ zuverlässig.
Alle Videos zum Thema
Videos zum Thema
Batterien und Akkumulatoren (5 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Batterien und Akkumulatoren (2 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation










 Bleiakkumulator – Aufladen
Bleiakkumulator – Aufladen
 Batterie und Akkumulator
Batterie und Akkumulator









