Farbstoffe
Die Welt ist farbig. Dies wird durch Farbstoffmoleküle bewirkt. Diese absorbieren bestimmte Farben (Wellenlängen) des Lichtes. Licht mit der Komplementärfarbe dieser Farbe wird dann reflektiert. Diese sehen wir dann.
Beliebteste Videos und Lerntexte
Jetzt mit Spass die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Farben und Farbstoffe
Farben finden wir überall in unserer Umwelt. Das grüne Gras, der blaue Himmel und das rote Blut sind nur einige Beispiele. Farben nehmen wir mit unseren Augen wahr. Dafür wird Licht benötigt. Bei sehr schwachem Licht erscheinen alle Dinge grau und unschärfer als bei hellem Licht. Daher kommt auch der Spruch "Nachts sind alle Katzen grau."
Auch das Bewegungssehen ist dann eingeschränkt. Aus diesem Grund sind Turnhallen meist sehr gut ausgeleuchtet. Wie erhält ein Gegenstand nun seine Farbe? Licht trifft auf diesen Gegenstand. Dabei wird ein Teil des Lichts absorbiert. Welcher Teil absorbiert wird, hängt von der Struktur des Stoffes ab. Das restliche Licht wird reflektiert. Die Farbe des reflektierten Lichts entspricht der Komplementärfarbe des absorbierten Lichts. Komplementärfarben liegen sich im Farbkreis genau gegenüber.
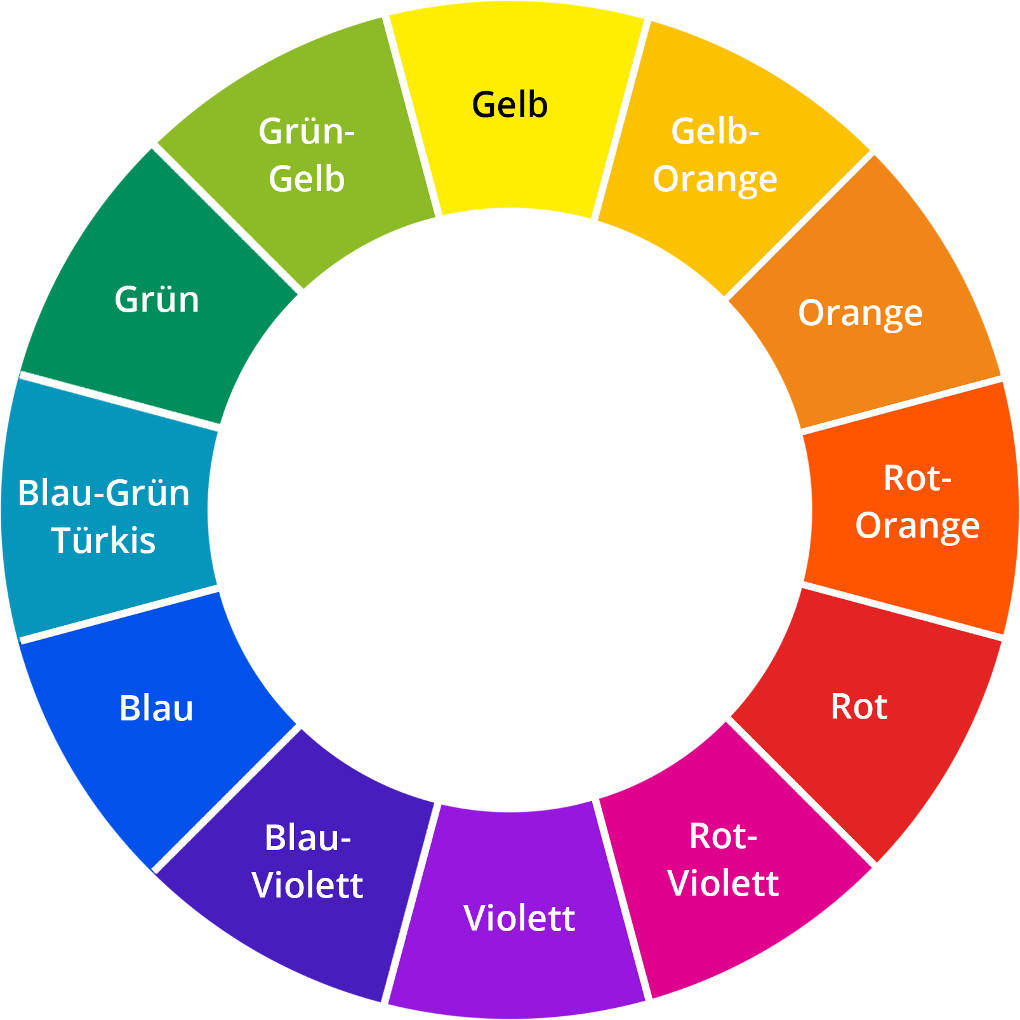
Absorbiert ein Stoff also gelbes Licht, so erscheint er uns in blauer Farbe. Farbstoffe sind chemische Verbindungen, die in der Lage sind, Materialien zu färben. Dabei werden sie in natürliche und synthetische Farbstoffe unterschieden. Zu den natürlichen Farbstoffen gehört das Purpur der Pupurschnecke, Indigo und Chlorophyll, der grüne Pflanzenfarbstoff. Synthetische Farbstoffe werden künstlich erzeugt. Es gibt verschiedenen Arten, die sich strukturell unterscheiden. Einige Arten synthetischer Farbstoffe sind Azofarbstoffe, Triphenylmethanfarbstoffe, Indigofarbstoffe und Anthrachinonfarbstoffe.
Aufbau und Wirkungsweise von Farbstoffen
Ausschlaggebend für die Farbwirkung eines Stoffes sind die Farbstoffmoleküle. Ein System aus konjugierten Doppelbindungen. Konjugiert bedeutet, dass sich Doppel- und Einfachbindung abwechseln. Bei diesem Polyen sind die konjugierten Doppelbindungen gut zu erkennen.
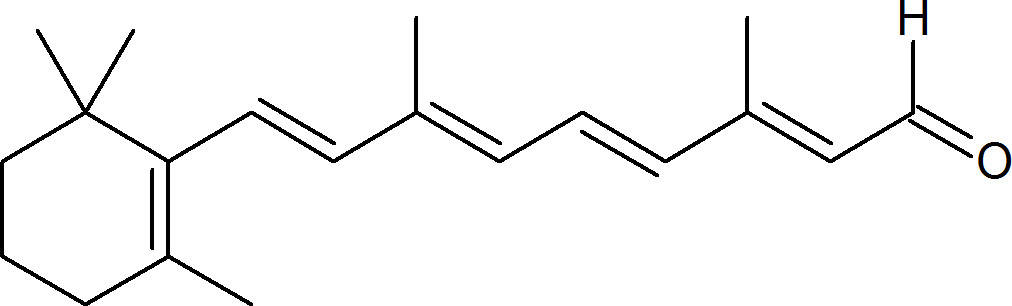
In den Doppelbindungen gibt es eine Bindung, die auf der Verbindungslinie zwischen den Kernen der Bindungspartner verläuft (Sigma-Bindung), und eine Bindung, die nicht auf dieser Verbindungslinie verläuft. Diese zweite Art der Bindung wird $\Pi$-Bindung genannt. Sind die Doppelbindungen konjugiert, können sie hin und her klappen. Daher spricht man von einem delokalisierten $\Pi$-Elektronensystem. Diese Elektronen können nun durch Energie, z.B. in Form von Licht, angeregt werden. Dadurch gelangen sie auf ein höheres Energieniveau. Dieser Energiesprung ist vom Wert aber genau festgelegt. Es kann also nur exakt diese Menge Energie aufgenommen werden. Diese Energie entspricht genau einer Wellenlänge. Wenn die aufgenommene Wellenlänge im sichtbaren Spektrum von 400 - 700 nm (Nanometer) liegt, erscheint uns der Körper in der Komplementärfarbe.

Je größer nun ein konjugiertes $\Pi$-Elektronensystem ist, desto kleiner wird der Energiesprung der Elektronen. Die Elektronen können also mit weniger Energie angeregt werden. Da die Energie mit steigender Wellenlänge abnimmt, wird also die Wellenlänge der absorbierten Strahlung größer, je größer das konjugierte System ist. In der Farbstoffchemie unterscheidet man in chromofore, auxochrome und antiauxochrome Gruppen. Chromofore Gruppen sind farbgebende Gruppen. Nach ihnen werden die Farbstoffe größtenteils eingeteilt. Wichtige chromophore Gruppen sind die Azogruppe (Azofarbstoffe), die Nitrogruppe und die Triphenylmethangruppe. Auxochrome Gruppen sind farbverstärkend Substituenten an Farbstoffmolekülen. Sie verschieben das Absorptionsmaximum hin zu größeren Wellenlängen. Antiauxochrome Gruppen besitzen einen elektronenanziehenden Effekt (Minus-I-Effekt). Dadurch unterstützen sie meist den Effekt der auxochromen Gruppen durch eine weitere Delokalisation der $\Pi$-Elektronen.
Verwendung
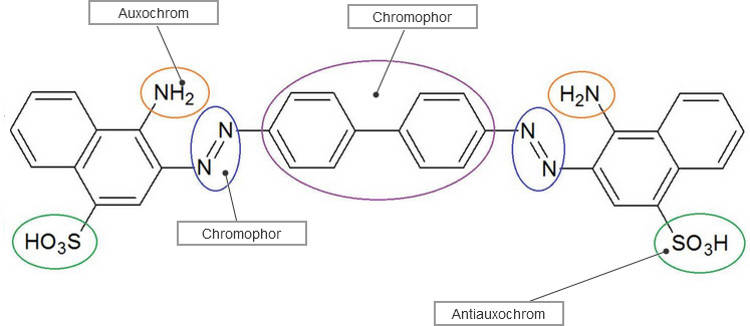
Besonders wichtig in der Farbstoffchemie sind die Azofarbstoffe. Sie tragen die chromophore Gruppe $-N=N-$, die Azogruppe. Sie sind sehr variabel und treten in vielen verschiedenen Farben auf. Wichtige Vertreter dieser Farbstoffart sind Kongorot (siehe Bild) und Alizaringelb. Azofarbstoffe dienen der Färbung von Textilien, Fetten, Holz und Papier. Einige dieser Farbstoffe sind sogar als Lebensmittelfarbe zugelassen.
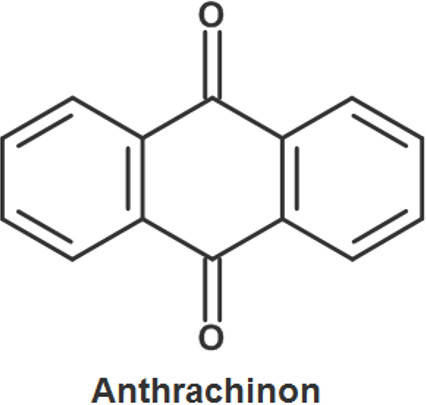
Antrachinonfarbstoffe besitzen ein Antrachinongerüst (siehe Bild) als gemeinsames Merkmal. Sie werden vorwiegend zur Färbung von Wolle eingesetzt. Sie gehören zu den Beizenfarbstoffen. Das bedeutet, damit sie an Fasern haften, müssen diese zuvor mit Aluminium- oder Chrombeizen behandelt werden.
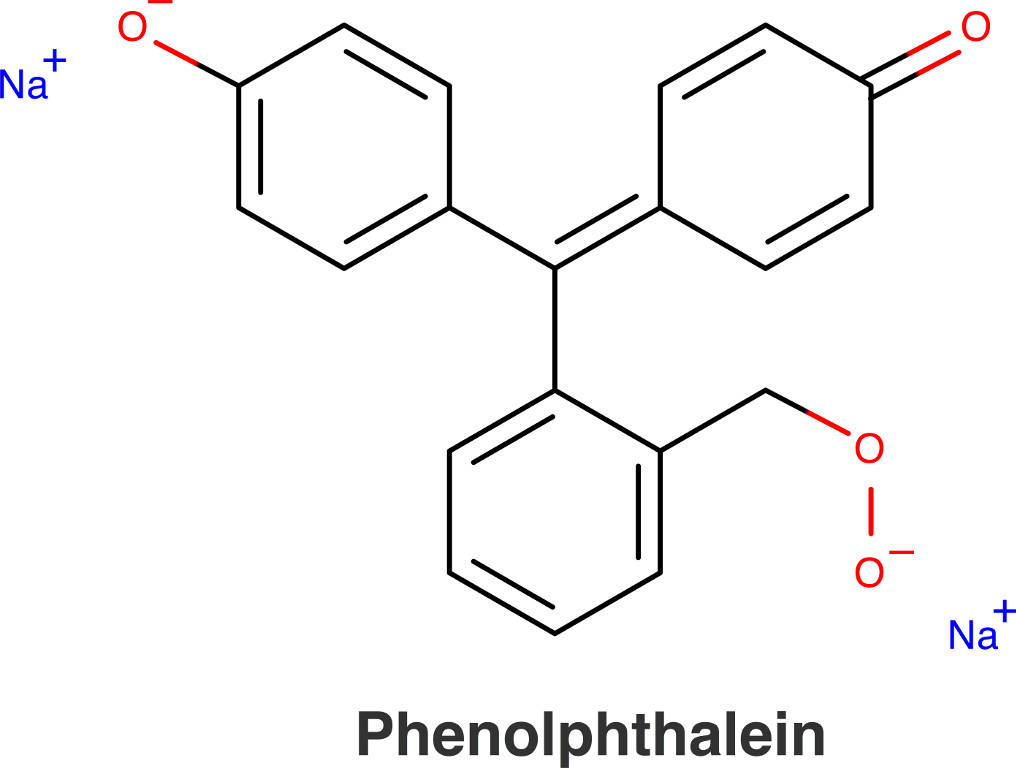
Eine weitere Anwendung von Farbstoffen ist die Verwendung als Indikatoren. Diese werden z.B. bei Titrationen und pH-Wert-Bestimmungen eingesetzt. Wichtige Indikatoren sind Phenolphtalien, Methylrot und Lackmus.
Färben von Naturfasern
Fasern die von Pflanzen, Tieren oder Mineralien stammen werden als Naturfasern bezeichnet. Im Gegensatz zu den synthetischen Fasern (Kunstfasern), lassen sie sich ohne Umwandlungsreaktionen verwenden.
Eine Gruppe sind die Pflanzenfasern, die sich unterschiedlich einteilen lassen und vielfältige Eigenschaften besitzen. Je nach Ursprung unterscheidet man beispielsweise Pflanzenfasern aus dem Leitbündel im Stamm oder Stängel, aus der Rinde und Samenfasern. Baumwolle ist zum Beispiel eine Samenfaser und stammt aus den Samenhaaren der Frucht der Baumwollpflanze.
Feine Tierhaare und Wolle sind auch Naturfasern und werden zum Beispiel durch das Scheren von Tieren gewonnen. Seidenfasern werden im Gegensatz dazu aus dem Kokon von Seidenraupen erhalten.
Aus Naturfasern lassen sich Taue, Netze, Seile oder Textilien für Bekleidung herstellen. Das Färben von Naturfasern spielt dabei besonders in der Textilindustrie eine Rolle und wurde bereits im Altertum beherrscht.
Eine etwas neuere Anwendung ist der Einsatz in Faserverbundwerkstoffen zusammen mit Kunststoffen, welche beispielsweise in der Möbel- und Automobilindustrie eingesetzt werden.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Farbstoffe (15 Videos, 1 Lerntext)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Farbstoffe (16 Arbeitsblätter)
-
 Farben und Farbstoffe
PDF anzeigen
Farben und Farbstoffe
PDF anzeigen -
 Farben – Einführung (Expertenwissen)
PDF anzeigen
Farben – Einführung (Expertenwissen)
PDF anzeigen -
 Farbstoffmoleküle – Was macht Moleküle farbig?
PDF anzeigen
Farbstoffmoleküle – Was macht Moleküle farbig?
PDF anzeigen -
 Farbstoffe – Einführung
PDF anzeigen
Farbstoffe – Einführung
PDF anzeigen -
 Farbstoffe – Einführung (Expertenwissen)
PDF anzeigen
Farbstoffe – Einführung (Expertenwissen)
PDF anzeigen -
 Aufbau eines Farbstoffs
PDF anzeigen
Aufbau eines Farbstoffs
PDF anzeigen -
 Aufbau und Wirkungsweise eines Farbstoffes
PDF anzeigen
Aufbau und Wirkungsweise eines Farbstoffes
PDF anzeigen -
 Azokupplung
PDF anzeigen
Azokupplung
PDF anzeigen -
 Zusammenhang zwischen Farbe und Struktur
PDF anzeigen
Zusammenhang zwischen Farbe und Struktur
PDF anzeigen -
 Zusammenhang zwischen Farbe und Struktur (Expertenwissen)
PDF anzeigen
Zusammenhang zwischen Farbe und Struktur (Expertenwissen)
PDF anzeigen -
 Farbstoffe und Färbemittel – Einführung
PDF anzeigen
Farbstoffe und Färbemittel – Einführung
PDF anzeigen -
 Färben mit Farbstoffen
PDF anzeigen
Färben mit Farbstoffen
PDF anzeigen -
 Färben mit Farbstoffen (Expertenwissen)
PDF anzeigen
Färben mit Farbstoffen (Expertenwissen)
PDF anzeigen -
 Färben von Naturfasern und Kunstfasern
PDF anzeigen
Färben von Naturfasern und Kunstfasern
PDF anzeigen -
 Wechselwirkungen zwischen Farbstoff- und Fasermolekül
PDF anzeigen
Wechselwirkungen zwischen Farbstoff- und Fasermolekül
PDF anzeigen -
 Phenolphthalein – Funktion eines Indikators
PDF anzeigen
Phenolphthalein – Funktion eines Indikators
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation































