Säure-Base-Reaktionen
Säuren und Basen reagieren unter Protolyse mit Wasser, die dadurch gebildeten Hydroniumionen und Hydroxidionen können sich neutralisieren.
Beliebteste Videos und Lerntexte
Jetzt mit Spass die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Dissoziation und Protolyse
Eine der ersten Theorien zu Säuren und Basen kam 1884 von Svante August Arrhenius. Laut ihm dissoziierten, d.h. zerfielen, Säuren und Basen und entfalteten so ihre Wirkung. In einer Reaktionsgleichung kann man es folgendermaßen darstellen.
$HA \longrightarrow~ H^+ + A^-$ für eine Säure und
$BOH \longrightarrow~B^+ + OH^-$ für eine Base.
Laut ihm waren also freie Wasserstoff-Ionen in wässriger Lösung vorhanden. Die basische Wirkung von beispielsweise Ammoniak konnte so aber nicht erklärt werden. Johannes Nicolaus Brönsted und Thomas Lowry prägten dann 1923 unabhängig voneinander den Begriff der Protolyse.

Dabei handelt es sich um eine Reaktion mit Protonenübergang $(H^+)$. Im Gegensatz dazu ist eine Redoxreaktion eine Reaktion mit Elektronenübergang. Eine Säure bzw. eine Base musste also erst mit Wasser reagieren, um sauer bzw. basisch zu sein.
$HA + H_2O \longrightarrow~ H_3O^+ + A^-$
$B + H_2O \longrightarrow~BH^+ + OH^-$
Neben dem Hydroxid-Ion als Base-Ion wurde so nun auch ein Säure-Ion, das Hydronium-Ion eingeführt. Ein Beispiel für eine Säure ist die Salpetersäure $HNO_3$. Die Protolysereaktion dieser Säure sieht wie folgt aus.
$HNO_3 + H_2O \longrightarrow~ H_3O^+ + {NO_3}^-$
Das Proton der Säure ist also auf das Wasser übergegangen worden. Auch für Ammoniak kann man mit Brönsteds Theorie nun eine Protolysereaktion aufstellen.
$NH_3 + H_2O \longrightarrow~{NH_4}^+ + OH^-$
Nach dieser Definition geben Säuren Protonen ab, spenden also Protonen, daher nennt man sie Protonendonatoren. Basen nehmen diese Protonen gerne auf, akzeptieren diese Protonen also, daher werden sie Protonenakzeptoren genannt.
Neutralisation
Eine besondere Form der Protolysereaktion ist die Neutralisation. Dabei reagiert eine Säure mit einer Base. Es entsteht dabei immer Wasser und ein Salz. Man kann also eine allgemeine Reaktionsgleichung aufstellen.
$Säure + Base \longrightarrow~Wasser + Salz$
Bei dieser Reaktion reagieren das Hydronium-Ion und das Hydroxid-Ion miteinander. Dabei entsteht Wasser.
$H_3O^+ + OH^- \longrightarrow~2~H_2O$
Das negativ geladene Säurerest-Ion und das positiv geladene Baserest-Ion bilden eine Salzlösung oder einen Niederschlag aus einem schwerlöslichen Salz. Diese Reaktion macht man sich für Säure-Base-Titrationen zunutze. Bei Titrationen geht es darum, die Konzentration einer unbekannten Probe mithilfe einer Maßlösung (bekannte Konzentration) zu ermitteln. Die Maßlösung wird mithilfe einer Bürette hinzugegeben.
Durch Ablesen des hinzugegebenen Volumens und Kenntnis der Reaktionsgleichung kann die Konzentration der unbekannten Lösung bestimmt werden. Um den Endpunkt der Säure-Base-Titration erkennen zu können, benötigt man einen geeigneten Indikator. Dieser zeigt einen Farbumschlag, wenn der Äquivalenzpunkt erreicht ist. Wird eine starke Base mit einer starken Base titriert, liegt dieser Punkt beim pH-Wert 7. Dies ist der Neutralpunkt, den auch destilliertes Wasser aufweist.
Konjugierte Säure-Base-Paare
In einer Säure-Base-Reaktion gibt es immer einen Partner, der als Säure reagiert, und einen, der als Base reagiert. Säuren sind Protonendonatoren, sie geben Protonen ab, und Basen sind Protonenakzeptoren, sie nehmen Protonen auf. Betrachten wir diese Reaktion nun als Gleichgewichtsreaktion. Dadurch ist auch die Rückreaktion möglich. In diesem Fall nimmt die vorherige Säure ein Proton auf. Sie fungiert also als Base.
Hinreaktion: $HA + H_2O \longrightarrow~ H_3O^+ + A^-$
Rückreaktion: $ H_3O^+ + A^-\longrightarrow~HA + H_2O $
Die Säure wird zur Base. Aus diesem Grund spricht man von konjugierten Säure-Base-Paaren. Diese werden in einer Reaktion wie folgt gekennzeichnet.
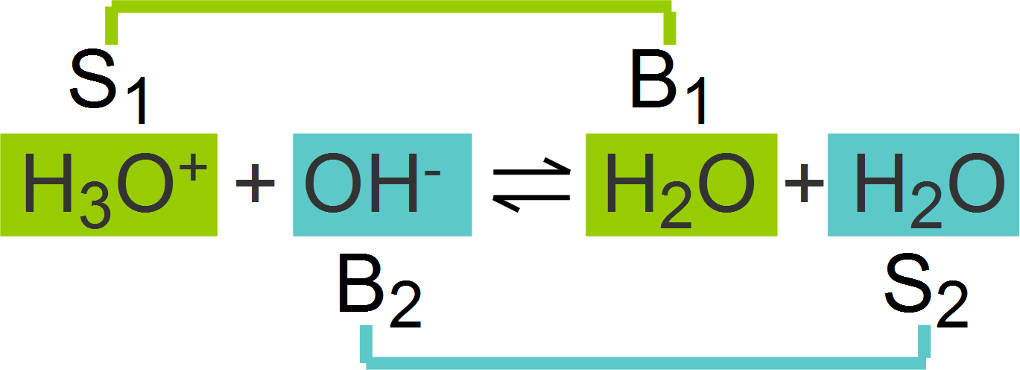
Das erste Paar wird mit einer 1 gekennzeichnet, also Säure 1 (S1) und Base 1 (B1), das zweite Paar dann dementsprechend mit einer 2 (S2 und B2). Es gibt Stoffe, die sowohl als Säure als auch als Base reagieren können. Diese Stoffe bezeichnet man als Ampholyte. Dazu zählen unter anderem Wasser, Hydrogencarbonat ${HCO_3}^-$ und Dihydrogenphosphat ${H_2PO_4}^-$.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Säure-Base-Reaktionen (9 Videos, 1 Lerntext)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Säure-Base-Reaktionen (5 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation
















 Säuren – Reaktionen
Säuren – Reaktionen
 Säure-Base-Paare und Ampholyte
Säure-Base-Paare und Ampholyte
 Bestimmung der konjugierten Säuren und Basen
Bestimmung der konjugierten Säuren und Basen
 Klassifizierung von Wasser nach Arrhenius, Brønsted, Lewis
Klassifizierung von Wasser nach Arrhenius, Brønsted, Lewis
 Neutralisation
Neutralisation












