Reaktionen und Reaktionswärme
Reaktionen können freiwillig, unfreiwillig oder auch gar nicht erfolgen. Aufschluss gibt darüber die Enthalpie und die Freie Gibbs Energie.
Inhaltsverzeichnis zum Thema
- Energetischer Ablauf einer Reaktion
- Exotherme und endotherme Reaktionen
- Exotherme Reaktion
- Endotherme Reaktion
Energetischer Ablauf einer Reaktion
Damit eine Reaktion abläuft, muss ihr eine von der Reaktion abhängige Aktivierungsenergie zugeführt werden. Durch diese Energie kommt die Reaktion in Gang. Bei der Bildung der Reaktionsprodukte wird immer Energie frei. Die Nettoenergiemenge einer Reaktion stellt die Reaktionsenthalpie dar, diese ist die energetische Differenz zwischen der inneren Energie der Edukte und der inneren Energie der Produkte. Für die Energiemenge gilt der erste Hauptsatze der Thermodynamik, der Energieerhaltungssatz:
„Energie kann weder erschaffen noch vernichtet werden, sie kann aber ihre Erscheinungsform wechseln“.
Bei den meisten chemischen Reaktionen wird die Reaktionsenthalpie daher in Form von Wärme oder Licht aufgenommen bzw. abgegeben. Es findet also eine wechselseitige Umwandlung von chemischer Energie in Wärmeenergie und/oder Lichtenergie statt.
Exotherme und endotherme Reaktionen
Mit den Begriffe exotherm und endotherm beschreibt man zwei unterschiedliche energetische Reaktionsformen.
Exotherme Reaktion
Bei einer exothermen Reaktion wird Wärme frei. Dies geschieht z.B. bei einer Verbrennung.

Der Energieumsatz wird hinter der Reaktion mit $\Delta H_r =$ gekennzeichnet. Eine exotherme Reaktion besitzt eine negative Differenz der Reaktionsenthalpien. Das zeigt an, dass das System Energie in Form von Wärme und Licht abgibt. Betrachtet man die Energiegehalte der Edukte (Ausgangsstoffe) und der Produkte, ergibt sich folgendes Bild.
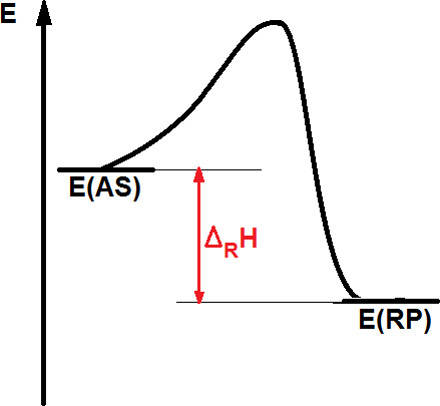
Du siehst am Anfang die Edukte. Sie besitzen mehr Energie als die Produkte. Im Laufe der Reaktion wird also Energie frei. Exotherme Reaktionen laufen meist freiwillig ab. Aber wie alle Reaktionen benötigen sie auch eine Aktivierungsenergie.
Endotherme Reaktion
Bei einer endothermen Reaktion wird Energie aus der Umgebung aufgenommen. Hier liegt das Energieniveau der Produkte höher als das der Edukte.
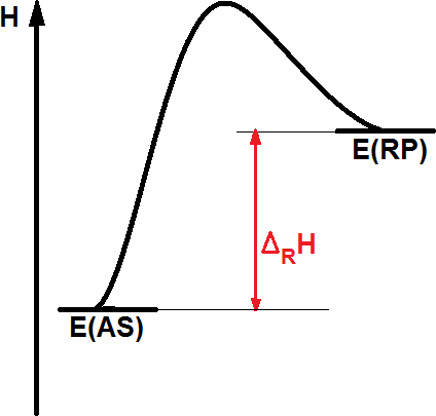
Das Vorzeichen der Reaktionsenthalpie ist in diesem Fall positiv. Ein Beispiel für solch eine Reaktion ist das Lösen von Salzen in Wasser.
Exergone und endergone Reaktionen
Um die Begriffe exergon und endergon zu verstehen, muss zuerst die freie Enthalpie geklärt werden. Die freie Enthalpie $G$ wird auch Gibbs-Energie oder Gibbsche freie Energie genannt. Es handelt sich um ein thermodynamisches Potential, das abhängig ist von den Variablen Temperatur, Druck und Stoffmenge. $G$ lässt sich mithilfe der inneren Energie $U$ und der Entropie $S$ wie folgt berechnen.
$G=U + p\cdot~V - T\cdot~S$
Da $H=U + p\cdot~V$, kann die freie Energie auch mittels der Enthalpie berechnet werden.
$G=H - T\cdot~S$
Mithilfe der Änderung der freien Enthalpie $\Delta G$ ist es möglich einzuschätzen, ob eine Reaktion freiwillig abläuft oder nicht:
- Ist $\Delta G< 0$, so handelt es sich um eine exergonische Reaktion. Diese läuft spontan ab.
- Ist $\Delta G> 0$, spricht man von einer endergonischen und damit nicht freiwillig ablaufenden Reaktion.
- Im Falle $\Delta G=0$ befindet sich das System im Gleichgewicht. Es läuft also sichtbar keine Reaktion mehr ab.
Kalorimetrie
Mithilfe der Kalorimetrie können Wärmemengen von Reaktionen gemessen werden. Dazu wird ein Kalorimeter eingesetzt. Wie dieses aufgebaut ist, siehst du hier.
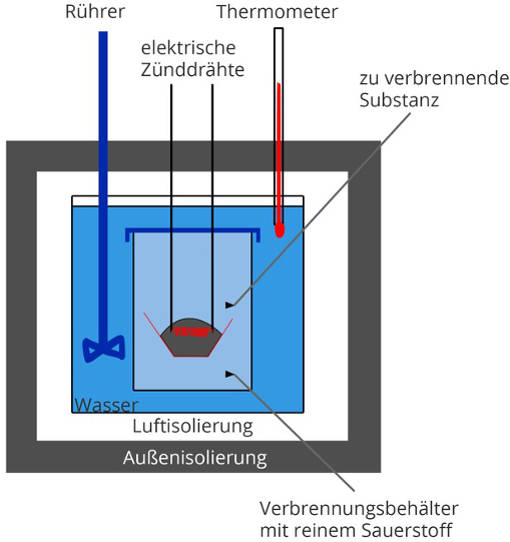
Im Inneren wird die Reaktion in Gang gesetzt. Dies geschieht durch eine Zündung. Die entstehende Wärme wird an das Wasserbad übertragen. Dieses Wasserbad wird mit einem Rührer durchmischt, damit die Wärmeenergie sich optimal verteilen kann. Den Temperaturanstieg kann man dann ablesen. Da man das Volumen und die spezifische Wärmekapazität des Wassers kennt, kann nun die aufgenommene Energie berechnet werden. Diese entspricht der abgegebenen Reaktionsenthalpie.
Alle Videos zum Thema
Videos zum Thema
Reaktionen und Reaktionswärme (3 Videos)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Reaktionen und Reaktionswärme (2 Arbeitsblätter)
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation






 Exergone und endergone Reaktionen
Exergone und endergone Reaktionen
 Bestimmung der Reaktionswärme durch Kalorimetrie
Bestimmung der Reaktionswärme durch Kalorimetrie












