Wasser und Wasserstoff
Wasser ist ein Dipolmolekül und besteht aus den Elementen Wasserstoff und Sauerstoff.
Beliebteste Videos und Lerntexte
Jetzt mit Spass die Noten verbessern
und sofort Zugriff auf alle Inhalte erhalten!
30 Tage kostenlos testenInhaltsverzeichnis zum Thema
Wasserstoff
Wasserstoff ist das erste Element des Periodensystems. Es besteht aus einem Proton im Kern und einem Elektron in der Elektronenschale. Wasserstoff bildet Bimoleküle $H_2$ und liegt bei Raumtemperatur gasförmig vor. Dieses Gas ist geruchlos, farblos und brennbar. Mit Sauerstoff bildet es ein explosives Gasgemisch, daher kann man es mit der Knallgasprobe nachweisen.
Verwendet wird Wasserstoff beispielsweise als Raketentreibstoff, zum Schweißen und für die Ammoniaksynthese. Früher wurden auch Luftschiffe damit befüllt, aber aufgrund der Brennbarkeit von Wasserstoff wurde es gegen ungefährliches Helium ausgetauscht.

Wasser – Aufbau und Eigenschaften
Wassermolekül Aufbau: Wie ist das Molekül Wasser aufgebaut? Wasser wurde früher als eines der vier Elemente betrachtet. Heute wissen wir, es handelt sich um eine Verbindung aus Sauerstoff und Wasserstoff.
Wasser besteht aus Molekülen. Diese setzen sich aus einem Sauerstoffatom und zwei Wasserstoffatomen zusammen. Diese Moleküle sind nicht linear, sondern gewinkelt. Der Winkel zwischen den Wasserstoffatomen beträgt ungefähr 104°.
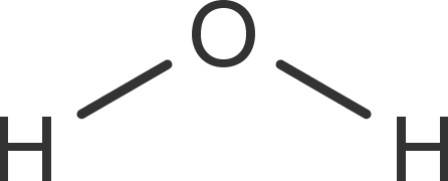
Dieser Winkel entsteht durch die zwei freien Elektronenpaare des Sauerstoffatoms. Sauerstoff zieht aufgrund seiner höheren Elektronegativität die Bindungselektronen stärker zu sich heran. Es liegt eine polare Atombindung vor. Dadurch bildet sich am Sauerstoffatom eine negative und an den Wasserstoffatomen eine positive Teilladung. Das Molekül ist demnach ein Dipol.
Aufgrund des Dipolcharakters des Wassers kommt es zu Wechselwirkungen zwischen den Molekülen. Der positive Ladungsschwerpunkt eines Wasserstoffatoms wird von dem negativen Ladungsschwerpunkt eines Sauerstoffatoms eines anderen Moleküls angezogen. Diese Wechselwirkung nennt man Wasserstoffbrückenbindung.
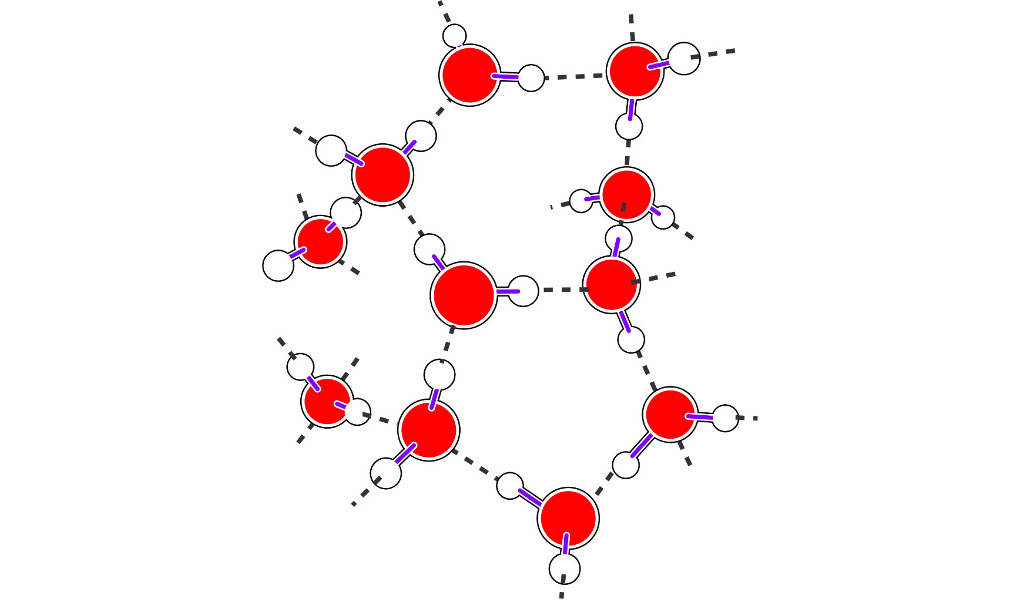
Durch diese Wasserstoffbrückenbindung kommt es zu einem stärkeren Zusammenhalt der Wassermoleküle. Dies äußert sich in der relativ hohen Schmelz- und Siedetemperatur von Wasser.
Auf diese innerstofflichen Kräfte geht auch die Dichteanomalie des Wassers zurück. Wasser ist der einzige bekannte Stoff, der sich beim Abkühlen nicht immer weiter zusammenzieht. Wasser hat bei 4°C seine höchste Dichte. Danach und davor verringert sie sich. Aus diesem Grund frieren Gewässer immer von oben nach unten zu und auch das Schlittschuhlaufen wird erst dadurch möglich.
Lösemittel Wasser
Kann man Wasser als Lösemittel nutzen? Es ist sogar ein ausgezeichnetes polares Lösemittel. Die meisten Salze und viele andere Stoffe sind in Wasser löslich oder mit Wasser mischbar. Salze bestehen aus positiven Kationen und negativen Anionen. Beim Lösevorgang werden diese Ionen an den Ecken und Seitenrändern des Kristallgitters herausgelöst und von Wassermolekülen umgeben. Man spricht von einer Hydratation von Ionen. Dabei lagert sich der positive Ladungsschwerpunkt (Wasserstoffatome) an die Anionen und der negative Ladungsschwerpunkt (Sauerstoffatom) an die Kationen an.
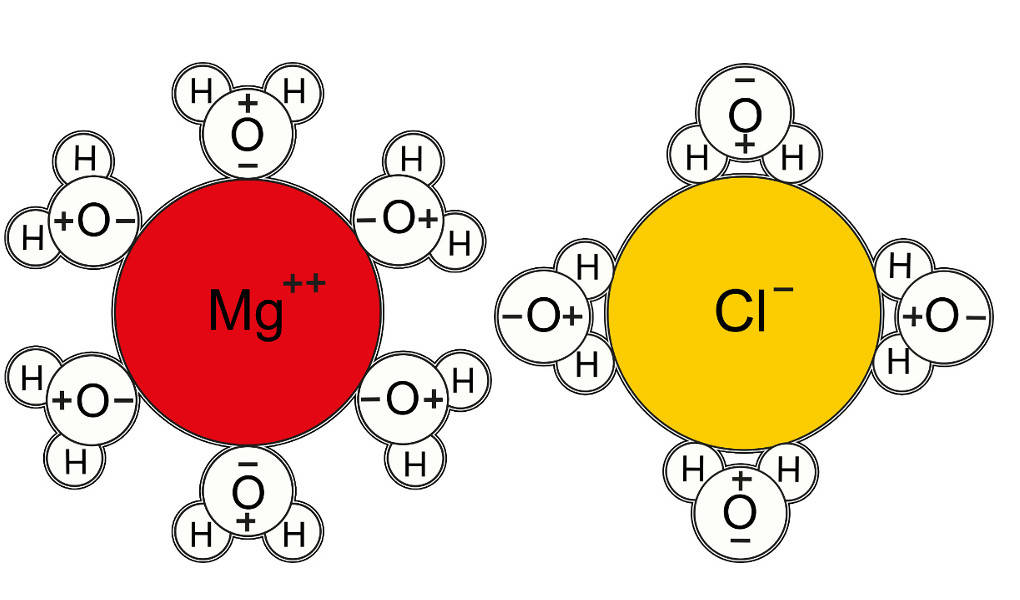
Die meisten organischen Verbindungen mischen sich schlecht oder gar nicht mit Wasser. Das liegt daran, dass sie meist sehr unpolar sind. Liegen allerdings polare Gruppen wie die Hydroxyl-Gruppe vor und ist der unpolare organische Rest klein, kann auch eine organische Verbindung in Wasser löslich sein. Dies ist z.B. bei Ethanol oder kurzkettigen Carbonsäuren der Fall.
Trinkwasser und Abwasser
Wasser ist essentiell für das Leben auf der Erde. Es wird von uns Menschen, den Tieren und Pflanzen zum Überleben benötigt. Es dient dabei als Transportmittel für viele Stoffe, die für Stoffwechselprozesse oder andere wichtige Vorgänge benötigt werden. In den Industriestaaten bekommen wir unser Wasser aus der Leitung oder dem Supermarkt.

In Entwicklungsländern muss dieses oft über weite Distanzen aus Brunnen geholt werden. Wasser ist ein wichtiger Rohstoff, der geschützt werden muss.
Unser Leitungswasser muss viele Voraussetzungen erfüllen. Es darf bestimmte Konzentrationen von gelösten Stoffen nicht überschreiten, keine Krankheitserreger enthalten und muss geruch- und farblos sein. Das verbrauchte Trinkwasser wird in Kläranlagen aufwendig gereinigt und uns wieder einwandfrei zur Verfügung gestellt. Dieser Vorgang kostet allerdings Geld und Energie. Daher ist es ratsam, sparsam mit Wasser umzugehen.
Alle Videos und Lerntexte zum Thema
Videos und Lerntexte zum Thema
Wasser und Wasserstoff (12 Videos, 2 Lerntexte)
Alle Arbeitsblätter zum Thema
Arbeitsblätter zum Thema
Wasser und Wasserstoff (10 Arbeitsblätter)
-
 Wasserstoff
PDF anzeigen
Wasserstoff
PDF anzeigen -
 Wasser – Element oder Verbindung?
PDF anzeigen
Wasser – Element oder Verbindung?
PDF anzeigen -
 Eigenschaften des Wassers
PDF anzeigen
Eigenschaften des Wassers
PDF anzeigen -
 Wasser – Aufbau des Moleküls
PDF anzeigen
Wasser – Aufbau des Moleküls
PDF anzeigen -
 Dichteanomalie des Wassers
PDF anzeigen
Dichteanomalie des Wassers
PDF anzeigen -
 Der Wasserkreislauf
PDF anzeigen
Der Wasserkreislauf
PDF anzeigen -
 Salzwasser und Süßwasser
PDF anzeigen
Salzwasser und Süßwasser
PDF anzeigen -
 Warum gefriert Meerwasser nicht bei 0 Grad Celsius?
PDF anzeigen
Warum gefriert Meerwasser nicht bei 0 Grad Celsius?
PDF anzeigen -
 Wasser als Lösemittel
PDF anzeigen
Wasser als Lösemittel
PDF anzeigen -
 Wasser als elektrischer Leiter
PDF anzeigen
Wasser als elektrischer Leiter
PDF anzeigen
Beliebteste Themen in Chemie
- Periodensystem
- Ammoniak Verwendung
- Entropie
- Salzsäure Steckbrief
- Kupfer
- Stickstoff
- Glucose Und Fructose
- Salpetersäure
- Redoxreaktion
- Schwefelsäure
- Natronlauge
- Graphit
- Legierungen
- Dipol
- Molare Masse, Stoffmenge
- Sauerstoff
- Elektrolyse
- Bor
- Alkane
- Verbrennung Alkane
- Chlor
- Elektronegativität
- Tenside
- Toluol, Toluol Herstellung
- Wasserstoffbrückenbindung
- Fraktionierte Destillation Von Erdöl
- Carbonsäure
- Ester
- Harnstoff, Kohlensäure
- Reaktionsgleichung Aufstellen
- Redoxreaktion Übungen
- Stärke und Cellulose Chemie
- Süßwasser und Salzwasser
- Katalysator
- Ether
- Primärer Alkohol, Sekundärer Alkohol, Tertiärer Alkohol
- Van-der-Waals-Kräfte
- Oktettregel
- Kohlenstoffdioxid, Kohlenstoffmonoxid, Oxide
- Alfred Nobel
- Wassermolekül
- Ionenbindung
- Phosphor
- Saccharose Und Maltose
- Aldehyde
- Kohlenwasserstoff
- Kovalente Bindung
- Wasserhärte
- Peptidbindung
- Fermentation




























